01
研究内容简介
本工作采用掺镁生物活性玻璃(MgBG)将sEVs编程成囊泡簇(EPPM),然后将其掺入水凝胶中,以创建一个全面的修复系统,增强sEVs和MgBG的递送,从而促进糖尿病伤口的快速愈合。这种水凝胶表现出优异的可注射、自愈合和生物粘附性能,使其成为DWs的理想物理屏障。此外,水凝胶还具有促进其杀菌活性的光响应特性。释放的EPPM显著增加了sEVs的细胞内摄取和积累,在巨噬细胞中增强约8.2倍,在内皮细胞中增强约16.7倍。EPPM簇有效诱导巨噬细胞M2极化,减少伤口部位的炎症反应,并募集细胞,从而促进血管生成和胶原蛋白沉积。这种修复系统为糖尿病伤口的综合治疗提供了一个新的平台(图1)。

一、EPPM纳米团簇的制备与理化性能表征
EPPM囊泡簇是通过sEVs和PPMB之间的蛋白质粘附和静电相互作用制备的,制备过程如图2a所示。TEM和粒径分析显示,sEVs呈茶托型,平均直径为63.1 nm ± 4.12 nm(图2b和c)。通过sEVs和PPMB共孵育制备EPPM囊泡簇。激光扫描共聚焦显微镜(LSCM)结果(图2d)用于观察sEVs与纳米颗粒的结合情况。使用细胞膜绿色荧光标记物将sEVs染成绿色。与未修饰的MgBG相比,PDA-MgBG、PP0.2-MB和PP0.5-MB中sEVs的荧光强度显著升高。sEVs均匀吸附在MgBG表面,随着sEVs负载速率的增加,绿色荧光强度逐渐增加。纳米颗粒的sEVs负载效率被进一步量化,结果如图2e所示。未处理MgBG的sEVs负载率为 4.4 ± 0.40 %,而仅用 PDA修饰的PDA-MgBG显示出一定的负载能力。PP0.5-MB的负载率分别为66.5 ± 0.46 %,显著高于其他纳米颗粒。此外,为了验证sEVs和PP0.5-MB之间的结合模式,zeta电位分析结果如图1f所示。PP0.5-MB带正电,与带负电的sEVs结合,导致EPPM囊泡簇的zeta电位位于两者之间,表明sEVs通过PDA介导的蛋白质粘附和静电相互作用实现负载。为分析各种处理对sEVs蛋白活性的影响,WB结果如图2g所示。与sEVs相比,在EPPM负载和EPPMO NIR(+)处理之间没有观察到显著差异。钙连蛋白在所有成分中均呈阴性,表明提取的sEVs中没有内质网污染。这些结果表明,PPMB负载和45 °C处理方法对sEVs蛋白活性的影响较小,并且通过一系列处理制备的EPPMO中的sEVs保留了优异的生物学功能。此外,与负载单纯的sEVs的相比,负载EPPM的EPPMO水凝胶在pH=7.4和6.5下具有中sEVs释放较为缓慢,可以满足伤口愈合过程中的阶段性需求(图2h)。
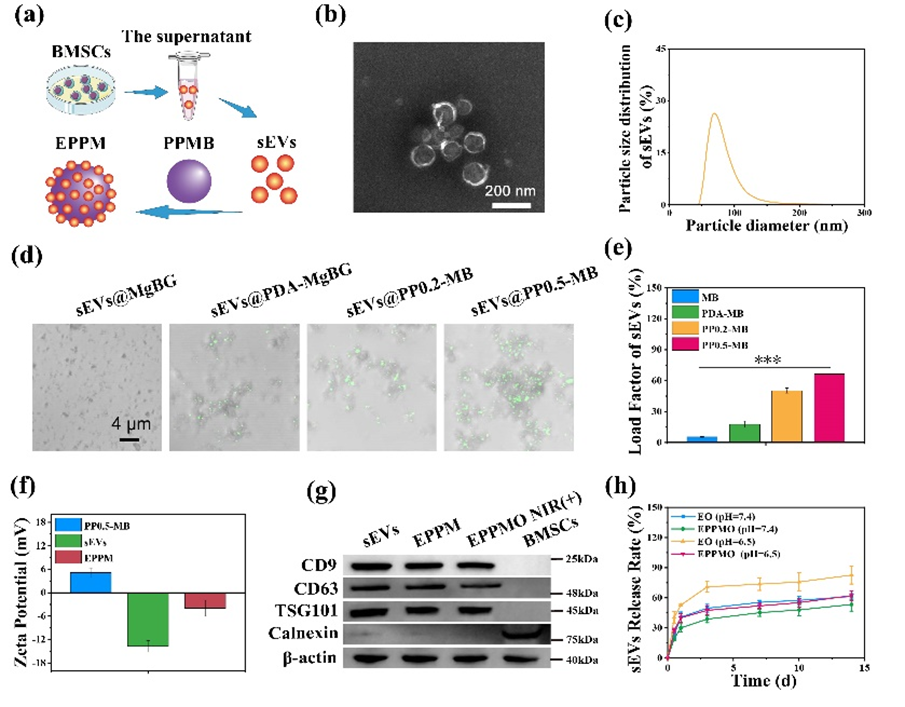 图2:EPPM纳米团簇的表征.(a)EPPM制备示意图;(b)sEVs的TEM图像;(c)sEVs的纳米粒径分布;(d)复合纳米颗粒的荧光图像;(e)sEVs的负载效率;(f)Zeta电位分析;(g)各组sEVs的Western blot结果;(h)在pH7.4和6.5下,水凝胶内sEVs的累积释放结果。
图2:EPPM纳米团簇的表征.(a)EPPM制备示意图;(b)sEVs的TEM图像;(c)sEVs的纳米粒径分布;(d)复合纳米颗粒的荧光图像;(e)sEVs的负载效率;(f)Zeta电位分析;(g)各组sEVs的Western blot结果;(h)在pH7.4和6.5下,水凝胶内sEVs的累积释放结果。二、EPPM纳米团簇的细胞内化效应
作者通过Transwell共培养系统评估EPPMO水凝胶的细胞学活性,如图3a所示。将细胞接种在孔的底部,并将50 μL水凝胶置于Transwell上腔室中,用于后续的细胞实验。通过激光共聚焦观察到制备的水凝胶表现出纳米团簇分布均匀(图3b)。结果证实,sEVs(红色)、PPMB(绿色)和EPPM均匀分布在水凝胶内。巨噬细胞在皮肤伤口部位的抗炎反应中起关键作用。分析RAW 264.7细胞对囊泡簇的内化(图3c)。12小时后,未修饰的MgBG组未观察到明显的绿色荧光,而PPMB被细胞内化但荧光强度低。与自由释放的sEVs相比,细胞对EPPM的内化增加了约8.2倍(图3d)。人脐静脉内皮细胞(HUVECs)是血管生成的关键参与者。HUVECs对纳米颗粒摄取的荧光成像与RAW 264.7细胞的荧光成像相同,EPPM显示细胞内化明显更高,与单独的sEVs相比约为16.7倍(图3e,f)。尽管从EO水凝胶中释放的sEVs可以被细胞捕获和内化,但它们的分散游离状态导致效率较低。未修饰的MgBG作为无机纳米颗粒,具有有限的细胞捕获能力。尽管PDA和PLL修饰增强了MgBG的细胞内递送,但它缺乏生物系统的识别性。EPPM囊泡簇由sEVs在PPMB界面上的自组装形成,利用sEVs的细胞膜结构促进细胞摄取。与内皮细胞相比,巨噬细胞表现出更高的吞噬活性,导致每种细胞类型的EPPMO囊泡簇增强程度不同。与使用sEVs作为超小纳米颗粒药物载体的传统策略不同,像MgBG这样的纳米颗粒(粒径大于sEVs)需要细胞膜包裹才能进行细胞内递送,但是单纯的细胞膜缺乏生物活性。将囊泡簇加载到EPPMO水凝胶中可保留sEVs活性,增强生物利用度,并促进MgBG细胞内递送和积累,有效调节细胞生物学功能。
图3:EPPM纳米团簇的细胞内化效应.(a)细胞与EPPMO水凝胶共培养示意图;(b)水凝胶内纳米颗粒分布的3D图像:sEVs(红色)和PPMB(绿色);(c)RAW 264.7细胞内化水凝胶释放的纳米颗粒:sEVs(红色)、MgBG(绿色)和PP0.5-MB(绿色);(d)RAW 264.7细胞内化的sEVs和MgBG的定量荧光面积结果;(e)HUVECs内化纳米颗粒的结果:sEVs(红色)、MgBG(绿色)和PP0.5-MB(绿色);(f)HUVECs内化的sEVs和MgBG的定量荧光面积结果。
三、SD大鼠糖尿病全层皮肤感染缺损模型
为验证水凝胶促伤口愈合的能力,作者使用Sprague-Dawley(SD)大鼠糖尿病感染伤口的全层皮肤缺损模型(图4a)。3天后,Blank组的伤口没有结痂并且出现化脓的现象(图4b),而OQ和EO水凝胶组没有表现出明显的化脓。此外,由于纳米簇的温和光热效应和QCS的抗菌特性,PPMO和EPPMO组的伤口结痂,无明显的感染和化脓的迹象。值得注意的是,EPPMO组的伤口显示出初步愈合的迹象。14天后,EPPMO组几乎完全愈合,其他水凝胶组愈合良好,而Blank组未完全结痂。组织形态的半定量分析(图4c和d)表明,EPPMO水凝胶组的伤口愈合率显著高于其他组。
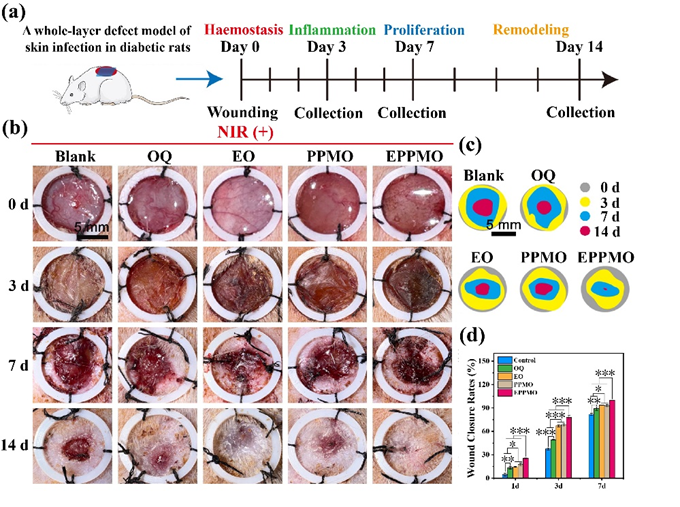
图4:SD大鼠糖尿病感染圈层皮肤缺损模型.(a)糖尿病背部皮肤缺损模型的造模过程;(b)创面愈合宏观展现图;(c)术后第3天、第7天和第14天五组皮肤伤口闭合示意图;(d)术后第3天、第7天和第14天五组伤口闭合率的定量数据。
持续的炎症反应是DWs的一个众所周知的特征。为进一步研究SD大鼠的炎症微环境和血管生成,对伤口组织进行了抗炎标志物IL-10(绿色,图5a、d)和促炎标志物TNF-α(红色,图5a、e)的免疫组织化学染色。第3天,Blank和OQ组显示TNF-α的显著阳性表达,IL-10的阴性表达。然而,随着抗炎物质的加入,EO和PPMO组表现出促炎因子的显着减少和抗炎因子IL-10的阳性表达。在sEVs和PPMB的协同作用下,EPPMO组促炎因子表达显著降低和IL-10阳性表达,表明抗炎能力优异。血管生成对于伤口愈合至关重要,为参与愈合过程的细胞提供氧气和营养,以支持组织再生。α-SMA(绿色)和CD31(红色)的免疫荧光用于评估DWs中的血管生成(图5b、f)。Blank组和OQ组显示低CD31表达,而掺入sEVs的PPMO组增加相关蛋白的表达。EPPMO组基于sEVs和PPMO的协同作用,表达显著增强。血管生成有助于维持细胞新陈代谢和增殖,从而促进糖尿病伤口愈合。
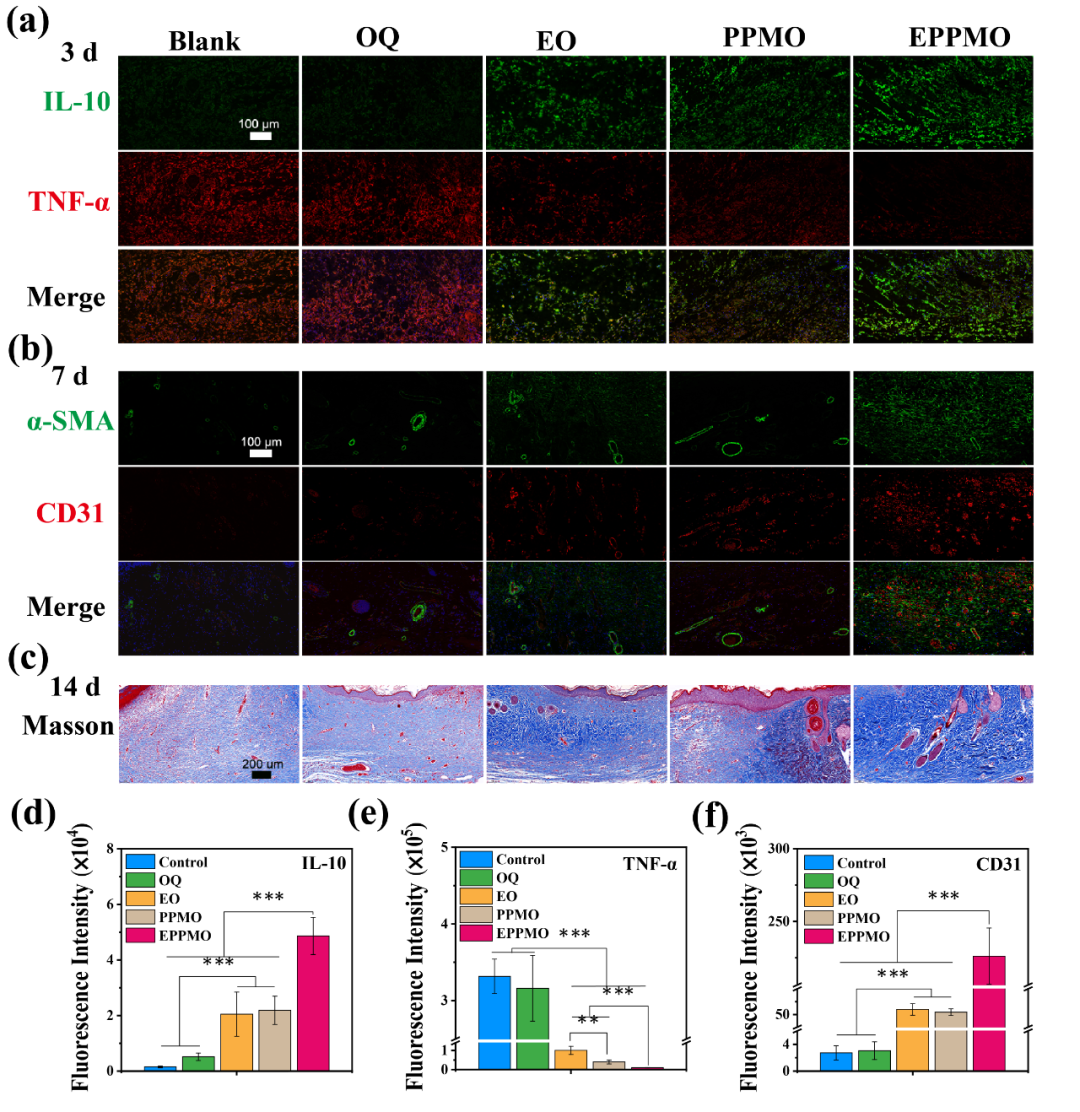 图5:组织学免疫荧光和Masson染色.(a)IL-10(绿色)和TNF-α(红色)的免疫荧光染色;(b)α-SMA(绿色)和CD31(红色)的免疫组织化学染色;(c)Masson染色;(d)IL-10免疫荧光染色荧光区的半定量结果;(e)TNF-α免疫荧光染色荧光荧光区的半定量结果;(f)CD31免疫荧光染色荧光区的半定量结果。
图5:组织学免疫荧光和Masson染色.(a)IL-10(绿色)和TNF-α(红色)的免疫荧光染色;(b)α-SMA(绿色)和CD31(红色)的免疫组织化学染色;(c)Masson染色;(d)IL-10免疫荧光染色荧光区的半定量结果;(e)TNF-α免疫荧光染色荧光荧光区的半定量结果;(f)CD31免疫荧光染色荧光区的半定量结果。02
论文第一及通讯作者简介
第一作者
王则涛:博士,中国科学院深圳先进技术研究院转化医学研究中心博士后,博士毕业于华南理工大学生物医学工程专业。主要围绕细胞外囊泡、多功能支架等研究方向,致力于骨修复、纤维环修复和骨关节炎治疗的基础研究及相关产品的开发与临床转化。相关成果以第一作者在Bioact. Mater.,J Mater Sci Technol,Appl. Mater. Today,Mater. Sci. Eng. C等国际重要学术期刊上发表SCI论文8篇;另外合作发表SCI论文15篇。
孙志鹏:华南理工大学材料科学与工程学院在读博士生。目前主要从事糖尿病创面修复、水凝胶材料、细胞外囊泡等方向的研究。
通讯作者
高会场:博士,华南理工大学医学院(国家人体组织功能重建工程技术研究中心)副教授,硕士生导师,博士毕业于华南理工大学材料学专业,依托国家人体组织功能重建工程技术研究中心开展研究工作,主要从事神经组织修复材料、多功能水凝胶研究,相关成果在Adv. Funct. Mater., Angew. Chem. Int. Ed.,Chem. Eng. J., Bioact. Mater., Adv. Healthc. Mater., 等国际重要学术期刊上发表SCI论文70余篇,他引2900余次,H因子32,申请国家发明专利 12项,其中5项已获授权,主持国家自然科学基金项目2项,广东省自然科学基金2项,广州市科技计划项目1项。
曹晓东:博士,华南理工大学(国家人体组织功能重建工程技术研究中心)教授、博士生导师,教育部新世纪优秀人才,中国生物材料学会理事,中国生物材料学会先进制造分会主任委员,中国生物医学工程学会生物材料分会副主任委员,入选“全球前2%终身影响力顶尖科学家”榜单。2005年毕业于武汉大学化学与分子科学学院,获博士学位;2005-2010年,先后在加拿大联邦政府农业食品部、新加坡南洋理工大学和美国北卡州立大学担任博士后研究员。目前主要从事生物医学3D打印及应用,功能化骨、软骨、椎间盘、皮肤、神经组织再生修复材料的构建及其生物适配分子机制等方面的研究。相关研究成果已在Adv. Funct. Mater., Angew Chem Int Ed,Bioact. Mater.等国际重要学术期刊上发表论文150余篇,Google Scholar检索他引超过10000次,H因子51,申请中国发明专利50余件,其中26件已获授权,参与编著3本。主持包括国家科技部“十三五”、“十四五”重点研发计划课题、国家自然科学基金面上项目、广东省重点领域研发计划项目等20余项。
03
资助信息
该研究获国家自然科学基金(52272276、52073103、52203164)、中央大学基本科研业务费(2022ZYGXZR105),中国博士后科学基金资助项目(2022M711183),广州市科技规划项目(2023A04J0971)的支持。
04
原文信息
Zetao Wang, Zhipeng Sun, Shuangli Zhu, Zhihao Qin, Xiaohong Yin, Yilin Ding, Huichang Gao#, Xiaodong Cao#. A multifunctional hydrogel loaded with magnesium-doped bioactive glass-induced vesicle clusters enhances diabetic wound healing by promoting intracellular delivery of extracellular vesicles. Bioactive Materials, 50 (2025) 30-46. DOI: 10.1016/j.bioactmat.2025.03.025
