将多种单克隆抗体(monoclonal antibody, mAb)固定于纳米颗粒表面是一种有前景的策略,旨在构建模拟多特异性抗体功能的纳米药物。然而,这类多特异性纳米抗体(multi-NanoAbs)的临床转化仍面临诸多挑战,如制备流程复杂、抗体亲和力不可避免地下降,以及载体生物安全性不足等问题。对此,华南理工大学(国家人体组织功能重建工程技术研究中心)王均/沈松/范亚楠开发了一种可用于抗体固定的通用型纳米适配体,并基于此构建多特异性纳米抗体。该适配体由Fcγ受体1(Fc gamma receptor 1, FcγR1)与人血清白蛋白(serum albumin)融合形成的重组蛋白与医用高分子材料聚左乳酸(poly(l-lactide))共同组成。研究结果表明,这种融合蛋白/聚合物构建的纳米适配体可通过其表面的FcγR1与抗体发生受体-配体特异性结合,避免了传统化学共价偶联的复杂操作,从而实现多种单抗的便捷、可控固定。基于该策略,研究者成功构建出多种multi-NanoAbs,并验证了其良好的治疗效果。此外,研究者还实现了人源化融合蛋白/聚合物纳米适配体的大规模制备,并在人源化免疫系统小鼠模型中证实了multi-NanoAb的抗肿瘤效能,展现出其良好的临床转化潜力。相关研究以Engineering multi-specific nano-antibodies for cancer immunotherapy发表在nature biomedical engineering上。
研究背景
多特异性抗体因其可同时靶向两个以上表位,正逐步成为新一代抗体药物的重要组成部分。与将具有不同作用机制的单抗联合使用或构建双特异性抗体相比,多特异性抗体具备多价结合能力、对多条信号通路的同步时空调控能力,并能够在靶向肿瘤细胞的同时调节多个免疫靶点,从而显著增强抗肿瘤效应。然而,尽管单抗的工业化生产已历经数十年技术成熟,多特异性抗体的功能复杂性仍给其大规模生产带来巨大挑战,常导致副产物产生,制造过程耗时、成本高且产率低。此外,在临床应用前还需克服多种后期稳定性问题,如降解、聚集、变性及片段化等。
将多种单抗共固定于纳米颗粒表面,构建多特异性纳米抗体(multi-NanoAbs),为实现多靶点治疗提供了一种可替代且前景广阔的策略。已有研究表明,部分纳米抗体确实展现出良好的抗肿瘤效应,但其构建方法普遍存在制备流程繁琐、抗体功能受损及纳米载体生物安全性差等问题,从而限制了其临床转化。例如,传统基于化学偶联或非定向固定的构建策略可能削弱抗体活性或遮蔽抗原识别位点。虽然也有研究尝试使用抗Fc抗体修饰的氨基化聚苯乙烯纳米粒子作为抗体固定平台,但聚苯乙烯本身生物相容性较差,且抗Fc抗体的偶联过程复杂,不适于规模化生产。
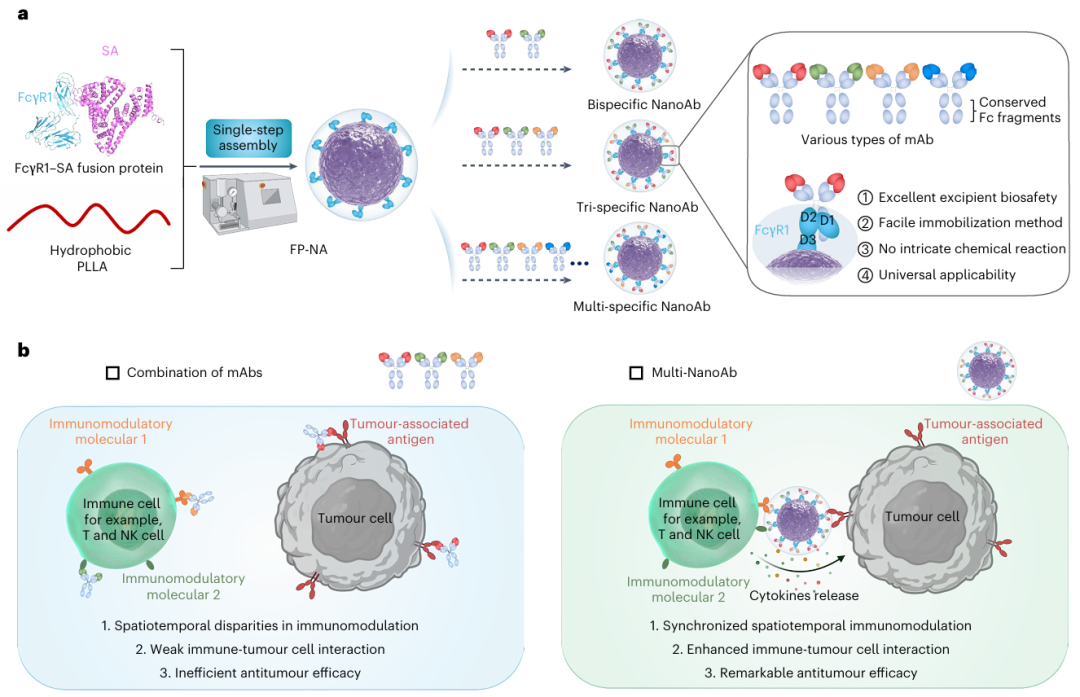
考虑到Fcγ受体I(FcγR1)是广泛表达于巨噬细胞等免疫细胞表面的Fc受体,其与免疫球蛋白G(IgG)Fc片段具有极高的亲和力,研究者提出,若将FcγR1固定于纳米颗粒表面,便可有效实现抗体的特异性结合与固定。此外,血清白蛋白(serum albumin, SA)作为血浆中最丰富的蛋白,其结构中含有多个疏水脂肪酸结合位点,能够与脂肪族聚酯类如聚乳酸(polylactic acid)自组装形成稳定的纳米结构。基于此,研究者创新性地提出,将FcγR1与SA融合形成重组蛋白,并与聚左乳酸(poly(l-lactide), PLLA)共同构建纳米平台,即融合蛋白/聚合物纳米适配体(fusion protein/polymer-based nano-adaptor, FP-NA),用于实现多种单抗的高效固定与multi-NanoAb构建。
与已有策略相比,FP-NA具有显著优势。首先,其组成简洁,仅需FcγR1–SA融合蛋白和PLLA两种组分,避免了抗Fc抗体的使用。其次,构建过程无需复杂的化学反应和外源试剂。第三,该平台可通过一体化工艺实现规模化生产,具有良好的工业转化前景。研究者进一步证实,FP-NA表面暴露的FcγR1可实现多种单抗的可控固定,从而高效构建多样化的multi-NanoAbs,并在多种小鼠肿瘤模型中验证其良好的治疗效果(见图1a,b)。此外,研究者还成功实现了人源化FP-NA的大规模制备,并在人源免疫系统小鼠模型中验证了multi-NanoAbs的抗肿瘤效应。研究者认为,该平台所构建的multi-NanoAbs不仅在肿瘤治疗中具有广泛前景,亦有望拓展至其他重大疾病的治疗。
实验结果1
FP-NA的设计与表征
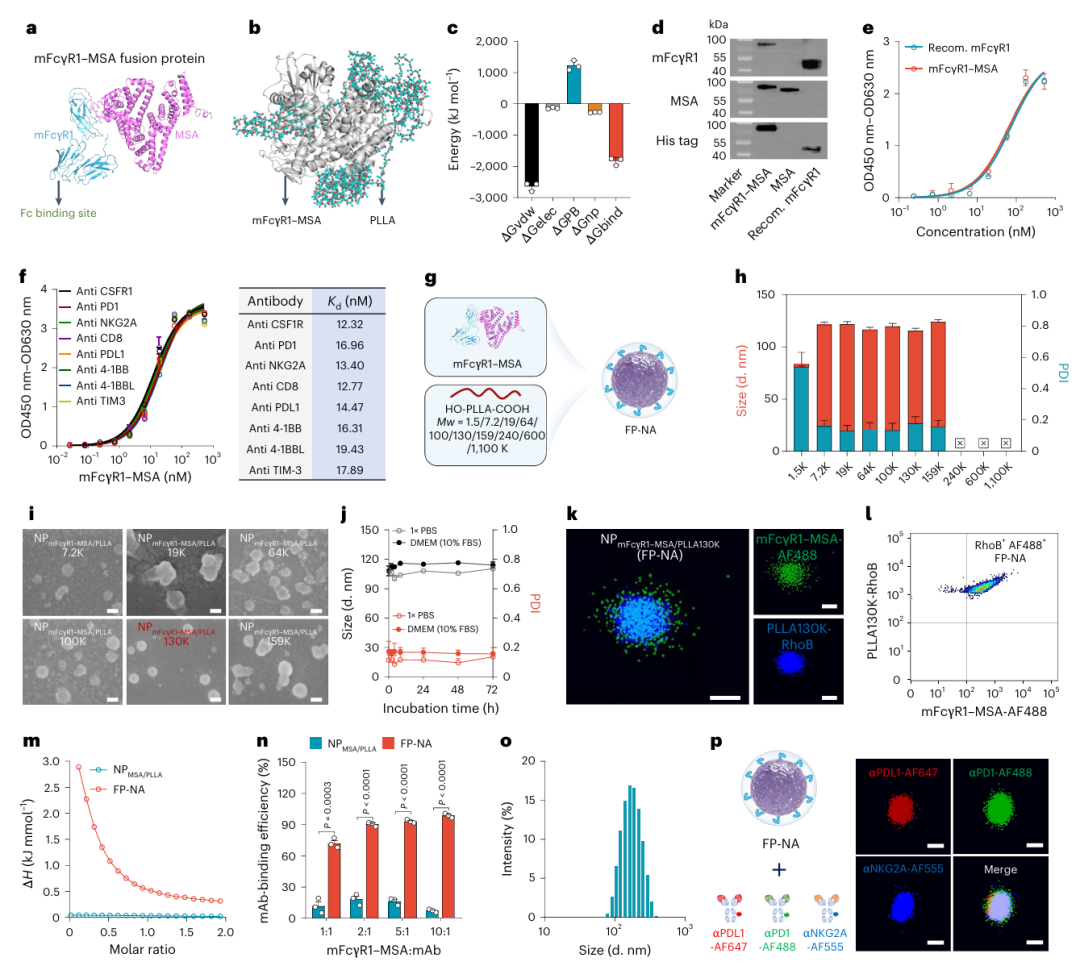
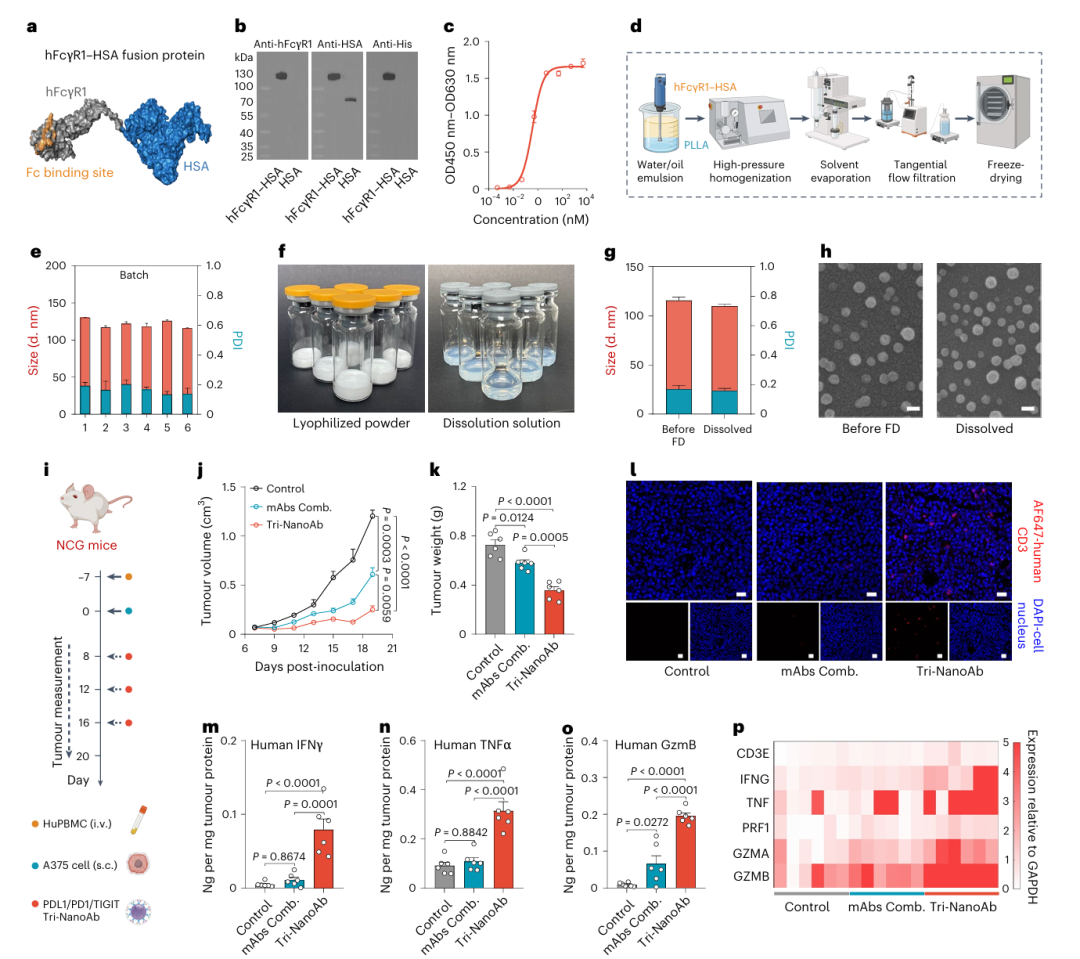
血清白蛋白(serum albumin, SA)作为血浆中最丰富的蛋白质之一,富含多个疏水结合位点,具有与长链脂肪酸(long-chain fatty acids, LCFAs)、代谢物及其他分子的高亲和力。著名的纳米药物Abraxane正是通过高压均质技术将紫杉醇结合于SA的疏水位点而制得。受此启发,研究者设计了FcγR1–SA融合蛋白,其结构由小鼠FcγR1(mFcγR1)胞外片段与小鼠SA(MSA)通过(G4S)₂连接肽连接,并在C端添加His标签以便纯化(见Fig. 2a)。研究者推测疏水性聚酯材料如聚左乳酸(PLLA)可与mFcγR1–MSA形成稳定纳米结构。分子动力学模拟结果显示,分子量为36 kDa的PLLA能缠绕并部分嵌入mFcγR1–MSA形成复合物,其结合自由能为–1,833 kJ/mol,表明两者之间可通过静电作用、范德华力及非极性溶剂化能等多重作用形成稳定结构(见Fig. 2b, 2c及补充图1)。
研究者利用重组毕赤酵母成功构建了mFcγR1–MSA的表达载体。融合蛋白经SDS-PAGE初步鉴定(补充图2),并通过FPLC(补充图3)与UPLC(补充图4)进一步纯化。LC-MS/MS肽图谱分析(补充图5)及免疫印迹验证了mFcγR1、MSA和His标签的存在(Fig. 2d)。ELISA结果显示mFcγR1–MSA与IgG2a抗体的结合能力与市售mFcγR1相当,亲和力(Kd)一致(Fig. 2e),对多种IgG2a亚型的结合能力也较为稳定,Kd范围维持在12–20 nM之间(Fig. 2f),说明该融合蛋白可作为通用的Fc段抗体锚定平台。
FP-NA的构建采用超声乳化-溶剂挥发一步法完成。在优化过程中,确定了最佳的水油体积比(5:1)和蛋白-聚合物质量比(5:1),并系统调节PLLA分子量(Mw)范围(1.5–1100 kDa)以优化纳米结构形成(Fig. 2g)。当PLLA Mw≥240 kDa时出现明显沉淀(补充图6),Mw<7.2 kDa时则分散性较差。在Mw为7.2–159 kDa范围内,FP-NA粒径为115–125 nm,PDI为0.13–0.18(Fig. 2h)。在PLLA为130 kDa时可获得粒子数量最多且稳定性良好(补充图7)。DLS与SEM分析进一步确认mFcγR1–MSA与PLLA130K构成的FP-NA具有规则球形、尺寸均一且在PBS及含10% FBS的DMEM中具有良好稳定性(Fig. 2i,j;补充图8、9)。耗散粒子动力学模拟(补充图10)揭示,过大或过小的PLLA分子量均不利于纳米结构的形成。此外,仅在PLLA Mw合适时,FP-NA方能形成紧密、稳定的结构。
共定位分析采用标记Alexa Fluor 488的mFcγR1–MSA与标记罗丹明B的PLLA130K进行STORM和NanoFCM验证,证实两者成功组装形成纳米结构(Fig. 2k,l)。通过凯氏定氮分析和冻干称重估算,FP-NA中融合蛋白占比为49.85%。静态多角度光散射测定FP-NA的平均分子量为2.412×10⁸ Da(补充图12),计算得到每个FP-NA中融合蛋白与PLLA的数值比例为1,252:930。
暴露于氯仿和超声条件下的mFcγR1–MSA仍保持与抗体相当的结合能力(补充图13),表明FP-NA构建过程未显著影响其功能。等温滴定量热(ITC)进一步验证FP-NA可选择性结合IgG2a抗体的Fc段(Fig. 2m),而非特异性构建的NPMSA/PLLA对照组无明显热变化。相较游离态融合蛋白,FP-NA表现出更高的抗体亲和力(补充图14),或因其表面呈现多价状态(multivalent state)所致,即FP-NA表面显示多个FcγR1结合位点。金标抗体结合分析及双荧光标记进一步从粒径、数量与结构层面证实mAbs与FP-NA表面结合(补充图15、16)。
ELISA定量评估表明,当FP-NA中mFcγR1–MSA与mAbs的质量比为10:1时,抗体固定效率可达95%(Fig. 2n),每个FP-NA平均固定约117个抗体分子(补充图17)。进一步构建了同时靶向PDL1/PD1/NKG2A的三特异性纳米抗体(Tri-NanoAb),呈现均一粒径分布(Fig. 2o)与弱负电荷(补充图18)。将三种抗体分别标记不同荧光后进行HPLC分析,验证可通过加料比例调控其在FP-NA表面分布比例(补充图19)。STORM成像观测到三种荧光信号共定位(Fig. 2p),并证实该Tri-NanoAb稳定性良好,未出现粒子解聚或抗体快速脱附(补充图20)。功能检测显示Tri-NanoAb较游离抗体对靶抗原具有略高亲和力(补充图21),三种抗体在FP-NA上的功能互不干扰(补充图22)。这些结果充分证明FP-NA具备卓越的多抗体固定能力,是构建功能多样化multi-NanoAbs的理想平台。
 实验结果2
实验结果2Tri-NanoAb在体外促进T细胞介导的细胞毒性作用
通过将多种单克隆抗体(mAbs)共价固定于FP-NA表面,可赋予所构建的多特异性纳米抗体(multi-NanoAbs)同时具备多特异性(抗体种类多样)和多价性(抗体数量丰富)的特征。研究者推测,这些特性使multi-NanoAbs相较于游离抗体组合在促进效应细胞与靶细胞相互作用及增强抗肿瘤免疫应答方面更具优势
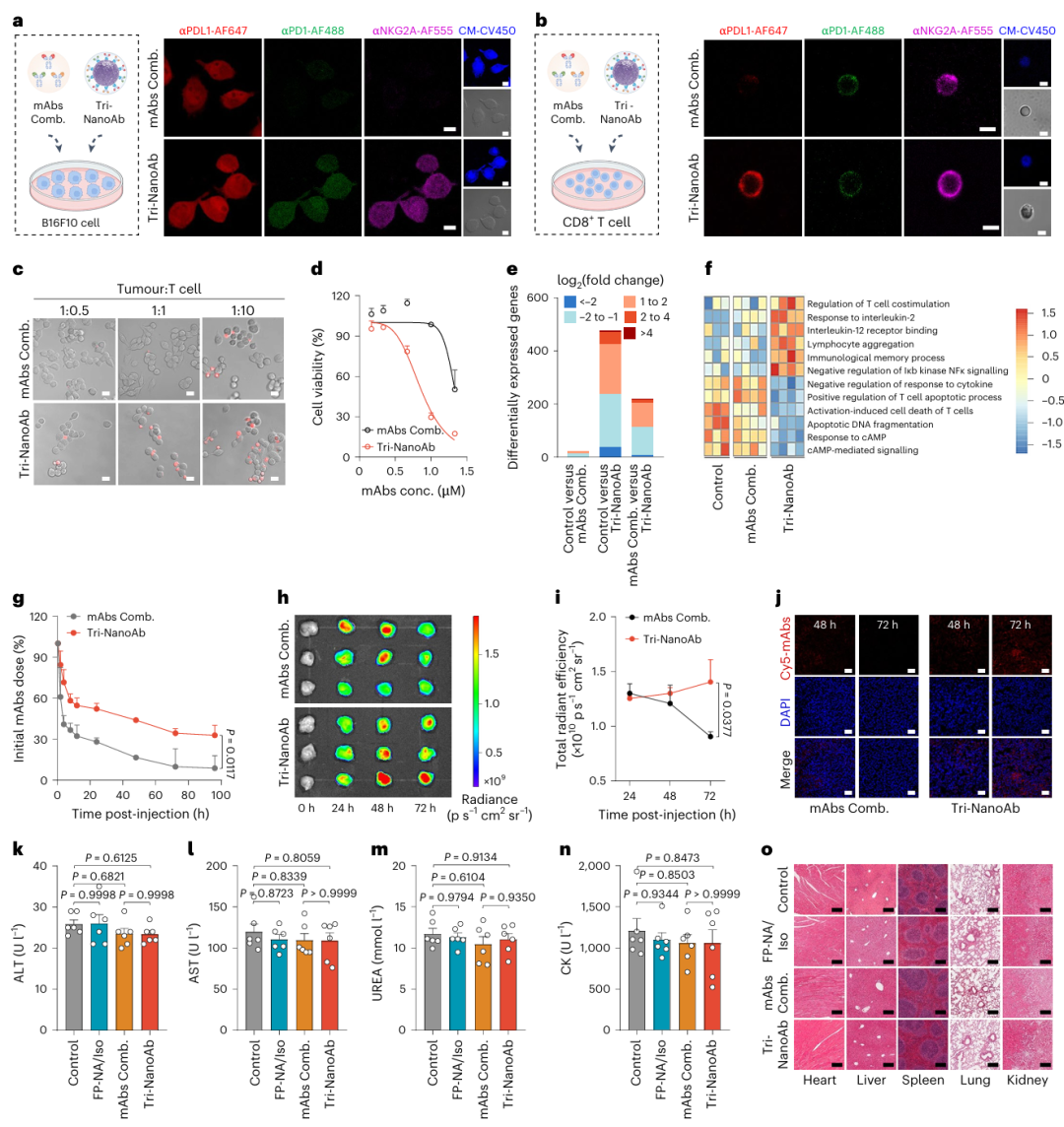
为验证该设想,研究者构建了一个靶向PDL1/PD1/NKG2A的三特异性纳米抗体(Tri-NanoAb),其中αPDL1用于识别表达程序性死亡配体1(PDL1)的肿瘤细胞,αPD1和αNKG2A分别阻断T细胞表面的免疫抑制受体PD1和NKG2A。实验将荧光标记的αPDL1、αPD1和αNKG2A(合称为mAbs组合)以及其Tri-NanoAb形式分别与B16F10黑色素瘤细胞和原代CD8+ T细胞共孵育,并进行激光共聚焦显微镜观察。结果表明,在mAbs组合组中,αPDL1主要结合肿瘤细胞,而αPD1和αNKG2A仅结合T细胞;而在Tri-NanoAb组中,通过αPDL1的介导,αPD1和αNKG2A也可附着于肿瘤细胞表面,反之亦然,使肿瘤细胞与T细胞表面均同时呈现三种抗体(Fig. 3a,b)。这种跨细胞的抗体展示方式使Tri-NanoAb成为连接T细胞与肿瘤细胞的“桥梁”,显著促进两者的接触与黏附(Fig. 3c),而游离抗体组并不具备该能力。高剂量Tri-NanoAb虽引发轻度同类细胞黏附现象,但并未观察到T细胞间的自噬行为(补充图23)。
为进一步评估其免疫活性,研究者使用表达荧光素酶的B16F10细胞(B16F10-Luc)与CD8+ T细胞共培养,在不同浓度下比较Tri-NanoAb与游离mAbs组合在诱导T细胞细胞毒性方面的差异。结果显示,Tri-NanoAb尤其在低剂量下显著增强T细胞的杀伤效应(Fig. 3d)。转录组分析揭示,Tri-NanoAb处理下的细胞中共有105个基因上调、113个基因下调(|log2(fold change)| > 1),与mAbs组合相比差异显著(Fig. 3e;补充图24)。进一步的GO通路GSVA分析(Fig. 3f)表明,Tri-NanoAb显著激活T细胞相关功能通路。与双特异性NanoAbs、三种mAbs混合物以及三种单NanoAbs联合应用相比,Tri-NanoAb显示出最强的肿瘤杀伤活性(补充图25),这归因于其多价状态下的协同激活能力,使T细胞更高效地分泌细胞毒性因子并诱导邻近肿瘤细胞凋亡。
Tri-NanoAb在体内的行为与安全性评估
研究者在进一步验证Tri-NanoAb的体内抗肿瘤效应前,系统评估了其血液循环、肿瘤富集能力以及生物安全性。
血药浓度检测显示,Tri-NanoAb组荧光标记抗体在小鼠血液中的清除速度显著低于游离抗体组合组,即使在注射后72小时仍保留初始剂量的34%(Fig. 3g)。大部分抗体以血清游离形式存在(补充图26)。在4T1乳腺癌异种移植模型中,研究者通过尾静脉注射给药后,在24、48和72小时采集主要器官与肿瘤组织进行IVIS成像分析,结果显示两组抗体均可积聚于肿瘤部位,但Tri-NanoAb组荧光信号在48小时后仍持续增强,72小时时肿瘤部位信号强度约为游离抗体组的1.5倍(Fig. 3h,i)。除肿瘤外,在肝脏和肺组织中也观察到一定荧光信号,48小时后趋于下降(补充图27)。Tri-NanoAb通过与肿瘤细胞和T细胞的双重结合,获得更强的结合力与滞留能力,从而在肿瘤组织中持续富集(补充图28)。共聚焦显微镜进一步验证其在48和72小时后肿瘤部位的高度富集(Fig. 3j)。
作为约120 nm大小的纳米颗粒,Tri-NanoAb同样具有常规纳米材料的优势,如通过EPR效应富集至肿瘤组织,并通过对流与扩散机制实现更深层穿透。此外,实验还证实Tri-NanoAb可结合外周血T细胞并随其浸润至肿瘤部位,可能进一步促进其渗透性(补充图29, 30)。综上所述,Tri-NanoAb可有效延长抗体在肿瘤组织中的停留时间,从而提升其治疗效能。
在安全性方面,研究者采用BALB/c小鼠分别给予mAbs组合、Tri-NanoAb及FP-NA负载的IgG2a等量同型对照抗体(FP-NA/Iso),每3天注射1次,共3次(q3dx3)。于末次给药后第3天采血及脏器采样进行毒理学分析。结果显示,AST、ALT、UREA、CK等肝肾与心功能指标在各组间无显著差异(P > 0.05)(Fig. 3k–n)。H&E染色显示,给药后1周及3个月各组主要脏器(心、肝、脾、肺、肾)均未出现明显的组织病理学异常(Fig. 3o,补充图31)。结果表明,按当前剂量与给药频率,FP-NA/Iso、mAbs组合及Tri-NanoAb均具有良好的体内生物安全性。
实验结果3
Tri-NanoAb在体内增强抗肿瘤免疫反应
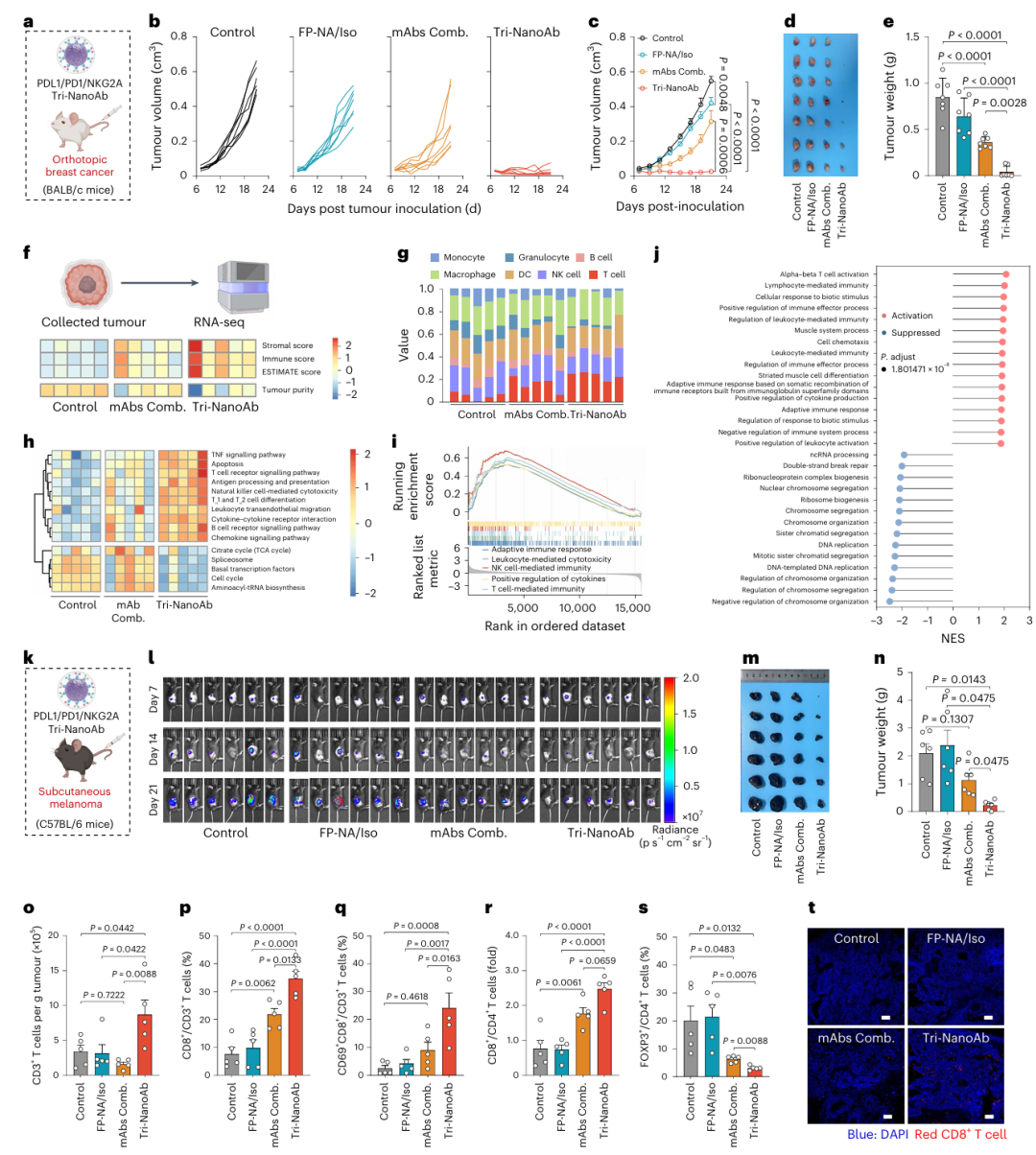
在证实Tri-NanoAb可显著增强T细胞对肿瘤细胞的杀伤作用并高效富集于肿瘤组织后,研究者进一步开展了一系列体内实验以评估其抗肿瘤治疗效果。首先在4T1乳腺癌正位移植小鼠模型中进行验证。该模型在分子特征上模拟晚期三阴性乳腺癌,对PD1/PDL1通路阻断治疗反应差,为临床相关性较高的挑战性模型。比较对照组、FP-NA/Iso、mAbs组合组与Tri-NanoAb组的治疗效果后发现,Tri-NanoAb显著抑制肿瘤生长,部分小鼠肿瘤完全消退;而游离mAbs组合仅在早期有延缓肿瘤进展的作用(Fig. 4a–c)。终点肿瘤组织照片与重量测量进一步佐证了其卓越疗效(Fig. 4d,e)。动物体重无明显下降,表明此剂量具有良好的耐受性(补充图32)。
对4T1肿瘤组织进行RNA测序(RNA-seq)后发现,Tri-NanoAb处理组在转录组表达谱上与其他组存在显著差异(补充图33)。采用ESTIMATE算法与ImmuCellAI-mouse平台评估肿瘤微环境,结果显示Tri-NanoAb组基质评分与免疫评分显著上升,而肿瘤纯度下降(Fig. 4f),表明免疫细胞浸润增加。进一步分析免疫细胞亚群发现,Tri-NanoAb显著提高肿瘤组织中CD8+ T细胞、CD4+辅助T细胞(TH)及NKT细胞比例,NK细胞变化不显著(Fig. 4g;补充图34)。免疫组化染色及数字病理扫描进一步确认CD8+ T细胞的显著浸润(补充图35)。
通路分析显示,Tri-NanoAb组与免疫功能相关的多条信号通路如T细胞受体信号、NK细胞介导细胞毒性、TH1/TH2细胞分化、趋化因子信号通路被激活,而TCA循环及细胞周期过程被广泛抑制(Fig. 4h;补充图36)。KEGG通路GSEA富集分析同样显示Tri-NanoAb组在抗肿瘤免疫通路上的富集显著优于mAbs组合组(Fig. 4i)。GO富集分析进一步指出,其激活的信号多与适应性免疫相关,受抑制通路多与DNA复制及细胞增殖相关(Fig. 4j)。蛋白互作网络分析揭示Tnf与Ifng为关键枢纽基因,其表达在Tri-NanoAb组显著上升,提示其可能为调控肿瘤微环境的核心因子(补充图37)。
此外,为评估免疫相关不良反应(irEAs)风险,研究者分析了irEA相关基因表达,结果表明在当前剂量下Tri-NanoAb及mAbs组合未诱导irEAs(补充图38)。
在动物水平进一步比较Bi-mAbs、Bi-NanoAbs、Tri-mAbs及Tri-NanoAb的疗效,发现NanoAb均优于其mAbs对应组,且Tri-NanoAb优于Bi-NanoAb,显示出最强的抗肿瘤效力(补充图39)。Tri-NanoAb的强效机制主要归因于三方面:(1)双免疫检查点抗体(抗PD1、抗NKG2A)协同激活肿瘤浸润T细胞并促进其增殖;(2)能同时识别肿瘤细胞与T细胞,增强两者接触,促使T细胞释放穿孔素和颗粒酶诱导肿瘤细胞凋亡;(3)多价效应增强其与肿瘤及T细胞结合能力,提高组织富集与免疫调节效果。
进一步在黑色素瘤模型中验证其抗肿瘤能力。将携带萤火虫荧光素酶的B16F10细胞接种于C57BL/6小鼠后,分别给予PBS、FP-NA/Iso、mAbs组合或Tri-NanoAb治疗,通过体内生物发光成像系统(IVIS)监测肿瘤进展。结果显示,FP-NA/Iso组肿瘤快速增长,mAbs组合组仅轻度抑制,而Tri-NanoAb组表现出显著肿瘤抑制效应,荧光信号显著减弱(Fig. 4l)。最终肿瘤照片与重量亦验证其疗效最强(Fig. 4m,n)。
多色流式细胞术结果显示,Tri-NanoAb处理组肿瘤组织中CD3+ T细胞显著增加,且CD8+ T细胞比例升高,激活型CD8+CD69+ T细胞亦上升(Fig. 4o–q)。CD8+/CD4+ T细胞比值提升2.8倍(对照组)、2.9倍(FP-NA/Iso组)及1.3倍(mAbs组合组)(Fig. 4r),提示免疫抑制微环境得到有效逆转。Treg细胞比例显著下降(Fig. 4s),并经免疫荧光与共聚焦显微镜确认CD8+ T细胞浸润增加(Fig. 4t)。T细胞耗竭实验进一步证实其依赖CD8+ T细胞介导的抗肿瘤效应(补充图42)。
综上所述,Tri-NanoAb不仅可增强T细胞浸润与增殖,还可显著重塑免疫抑制微环境,从而展现出卓越的体内抗肿瘤免疫疗效。
实验结果4
FP-NA平台用于构建多种类型的多特异性纳米抗体(multi-NanoAbs)
在明确FP-NA纳米抗体在乳腺癌和黑色素瘤模型中展现出卓越抗肿瘤效能后,研究者进一步探讨其作为通用平台用于构建多种双/多特异性纳米抗体的潜力,以实现多肿瘤类型的高效治疗。
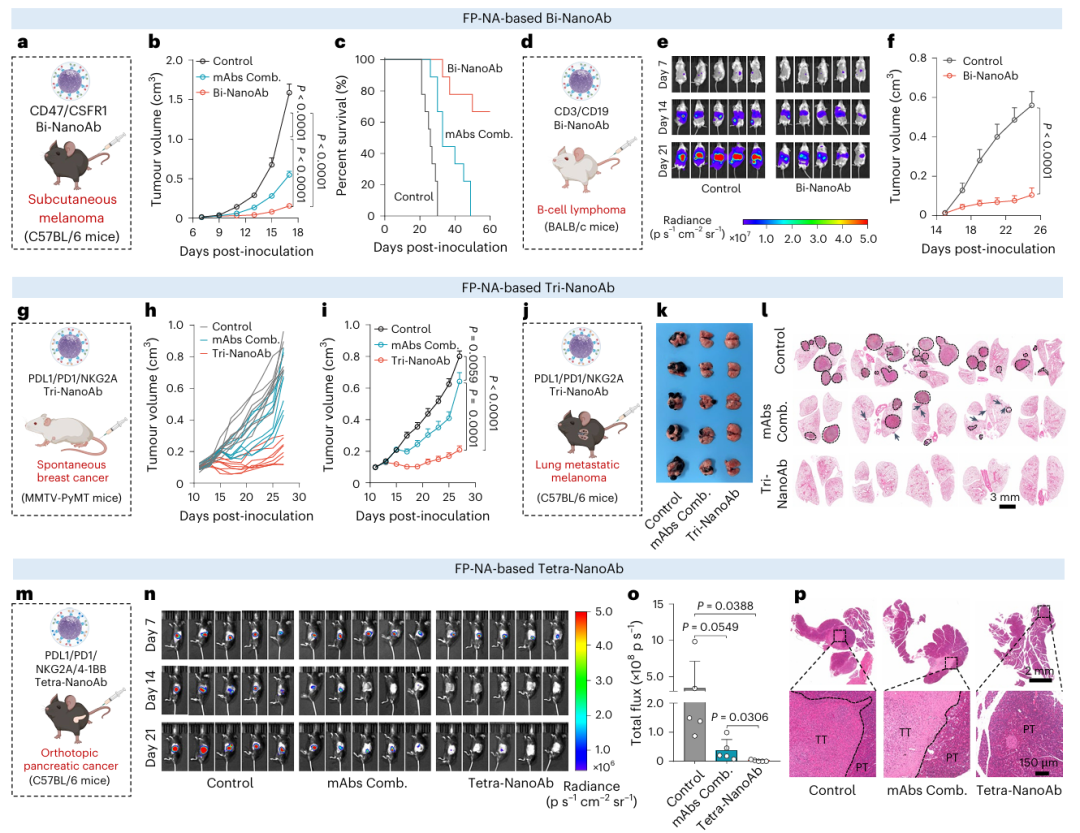
多种肿瘤细胞高度表达CD47,该分子通过与巨噬细胞表面的信号调节蛋白α(SIRPα)结合,传递“请勿吞噬”信号,抑制吞噬行为。阻断CD47–SIRPα信号轴可有效解除巨噬细胞吞噬肿瘤细胞的抑制。研究者以抗小鼠CD47抗体(MIAP301克隆)和识别巨噬细胞CSF1R的抗小鼠CSF1R抗体(AFS98克隆)共同构建了靶向CD47与CSF1R的双特异性纳米抗体(Bi-NanoAb)(Fig. 5a)。治疗结果显示,Bi-NanoAb在延缓肿瘤进展与提高生存率方面远超游离抗体组合组(Fig. 5b,c)。其中Bi-NanoAb组小鼠在肿瘤接种49天后仍有67%存活,而对照组与mAbs组合组则全部死亡,其显著疗效可能源于其促进巨噬细胞与肿瘤细胞的高效接触与吞噬。
另一个Bi-NanoAb的应用案例是构建CD3/CD19双特异性纳米抗体,用于增强CD3⁺ T细胞对CD19⁺ B细胞淋巴瘤的识别与杀伤(Fig. 5d)。在系统性A20淋巴瘤模型(萤光素酶标记)和皮下肿瘤模型中,Bi-NanoAb均表现出卓越的抗肿瘤活性(Fig. 5e,f)。
作为FP-NA平台代表性的三特异性抗体,PDL1/PD1/NKG2A Tri-NanoAb在乳腺癌自发模型(MMTV-PyMT)与黑色素瘤肺转移模型中也展现出显著疗效。在MMTV-PyMT乳腺癌模型中,该抗体组的肿瘤抑制效果优于mAbs组合组(Fig. 5g–i)。在B16F10肺转移模型中,Tri-NanoAb几乎完全阻断黑色素瘤的肺部转移形成,与mAbs组合组相比在结节数量与体积方面表现出压倒性优势(Fig. 5j–l),并经H&E染色验证。
考虑到胰腺癌是当前最具挑战性的恶性肿瘤之一(五年生存率不足7%),研究者基于FP-NA平台进一步构建了PDL1/PD1/NKG2A/4-1BB四特异性纳米抗体(Tetra-NanoAb),期望其能全面激活T细胞并增强其对胰腺癌的杀伤能力。该策略通过将四种单抗共固定于FP-NA表面实现。在Pan02-Luc正位胰腺癌模型中,研究者使用IVIS系统对肿瘤生长进行实时无创追踪(Fig. 5m)。治疗过程中分别给予对照组、mAbs组合组及Tetra-NanoAb组等量抗体,每周监测肿瘤变化。结果显示,Tetra-NanoAb治疗后肿瘤体积持续缩小,部分小鼠出现早期缩小后轻微复发趋势(Fig. 5n,o),H&E染色进一步证实Tetra-NanoAb可显著缩小胰腺肿瘤病灶范围(Fig. 5p)。
综上,FP-NA平台凭借其高效、温和、可扩展的抗体固定能力,能方便快捷地构建多种双/三/四特异性纳米抗体。通过精确组合不同靶点的单抗,FP-NA为多种肿瘤免疫治疗提供了灵活而强大的构建方案,展现出良好的通用性、适配性和临床转化潜力。
 实验结果5
实验结果5FP-NA与multi-NanoAbs的临床转化前景
FP-NA作为一种通用的抗体固定平台,能够通过精准筛选抗体组合,便捷高效地构建多种双/多特异性纳米抗体(multi-NanoAbs)。尽管目前基于FP-NA的multi-NanoAbs已在多种小鼠肿瘤模型中验证了其显著抗肿瘤效能,但其临床转化潜力仍需进一步评估。因此,研究者着手开发人源化版本的FP-NA(hFP-NA),其中融合蛋白由人源FcγR1胞外结构域与人血清白蛋白(HSA)组成(hFcγR1–HSA,Fig. 6a)。同时,还系统性地优化了人源化FP-NA的放大生产工艺,并在人源免疫系统小鼠模型中评估了其构建的人源化纳米抗体的治疗效果。
人源融合蛋白hFcγR1–HSA通过哺乳动物表达系统CHO-K1Q细胞获得,并利用免疫印迹(Fig. 6b)与ELISA(Fig. 6c)验证了其功能结构与对人源IgG1 Fc段的高亲和性。
在hFP-NA中试生产中,研究者设计了包括预乳化、高压均质、溶剂去除、纯化、无菌过滤与冻干等步骤的完整生产流程(Fig. 6d)。通过正交设计实验策略,系统筛选了关键物料属性(如蛋白浓度、蛋白/PLLA比例、水油体积比等)和关键工艺参数(如分散速度、均质压力与循环次数等),并以粒径、PDI、蛋白包封率与载药量等作为质量控制指标,优化了hFP-NA的制备方案。多批次制备结果显示,hFP-NA的平均水合粒径稳定在110–130 nm范围内,PDI低于0.23(Fig. 6e)。冻干产品形成致密多孔结构,外观良好,溶解性佳(Fig. 6f),且冻干前后粒径与PDI基本不变(Fig. 6g),扫描电镜(SEM)观察也未见结构显著变化(Fig. 6h)。
进一步,研究者通过将人源αPDL1、αPD1与αTIGIT三种抗体固定于冻干复溶的hFP-NA表面,构建出PDL1/PD1/TIGIT三特异性纳米抗体(Tri-NanoAb)。在A375人源黑色素瘤异种移植模型中,利用移植人外周血单个核细胞(PBMCs)的NCG小鼠进行疗效评估(Fig. 6i)。研究流程为:先于肿瘤接种前7天通过尾静脉注射人PBMCs建立人源免疫系统模型,于第8天皮下注射A375细胞形成肿瘤,随后每隔3天给予对照IgG1、mAbs组合或Tri-NanoAb共3次治疗,定期监测肿瘤生长。人源PBMC小鼠模型的血液免疫细胞比例变化见补充图43。
治疗结果显示,Tri-NanoAb组肿瘤持续缩小,显著优于mAbs组合组,其体现在肿瘤生长曲线(Fig. 6j)及终点肿瘤重量测定(Fig. 6k)中。免疫荧光分析表明,Tri-NanoAb可显著增加CD3+ T细胞在肿瘤组织中的浸润水平(Fig. 6l)。此外,Tri-NanoAb处理后肿瘤组织中关键细胞毒性因子如干扰素γ(IFNγ)、肿瘤坏死因子α(TNFα)与颗粒酶B(GzmB)的表达量显著上升(Fig. 6m–o)。qPCR数据进一步验证Tri-NanoAb能增强T细胞浸润并提升其细胞毒效应(Fig. 6p)。
综上所述,该研究从蛋白工程、规模化生产、冻干稳定性、功能构建、动物模型验证等多个维度全面评估了人源化FP-NA(hFP-NA)的可行性,并在免疫重建的人源小鼠模型中初步验证了其良好的治疗潜力。FP-NA平台不仅具备良好的可扩展性与稳定性,也为多种临床适应症的抗体组合治疗提供了高度通用与可调的工程解决方案,展现出极具前景的临床转化潜力。
总结
综上所述,研究者成功设计了一种由两种具有优异生物安全性的组分构成的融合蛋白-聚合物纳米适配体(FP-NA),用于高效固定单克隆抗体(mAbs)并构建多特异性纳米抗体(multi-NanoAbs)。该平台有效克服了既往multi-NanoAbs在临床转化中面临的两大核心难题:其一是构建过程复杂、操作难度大,其二是载体本身存在生物安全性隐患。
借助FP-NA平台,研究者首次实现了多至四种、五种甚至更多抗体特异性在同一纳米结构中的协同固定,这一能力是传统抗体工程技术难以实现的。FP-NA不仅在构建效率、抗体亲和力保持和纳米结构稳定性方面表现出色,还具备良好的工艺放大性和冻干保存稳定性,显著提升了multi-NanoAbs临床转化的可行性。
更为重要的是,FP-NA和其衍生的multi-NanoAbs并不仅限于肿瘤治疗,在自身免疫疾病、感染性疾病、移植物排斥反应、慢性炎症乃至组织再生等多个疾病领域亦展现出广阔应用前景。凭借其高通用性、高灵活性和可模块化的设计理念,FP-NA有望成为抗体药物开发的重要转化平台,推动多特异性抗体治疗从概念走向临床实践。
