
文章创新性地提出将2,3-环氧丙基三甲基氯化铵(EPTAC)与高分子量I型胶原结合,显著提升了胶原在中性溶液中的溶解性,模拟分析表明该机制主要依赖于静电相互作用。为验证角膜细胞对凸面微环境的响应特性及所提打印策略对角膜基质再生(特别是抑制角膜纤维化)的有效性,本文同步构建了平面与凸面两种拓扑结构的角膜模型。通过系统分析这两种结构对角膜细胞-成纤维细胞转化及表型维持的影响,形态学观察结合基因与蛋白表达检测证实:凸面结构能为维持角膜细胞表型提供最优微环境。体内移植实验进一步表明,相较于平面结构,凸面角膜能更有效抑制纤维化进程。这些发现证实凸面角膜有望成为治疗角膜基质再生具有转化潜力的新策略。
【本文亮点】
(1)通过EPTAC与I型胶原结合,显著提升胶原在中性溶液中的溶解性,为角膜生物墨水开发提供新方案,突破传统材料局限。
(2)3D打印凸面角膜模型证实其优于平面结构,能有效维持角膜细胞表型并抑制纤维化,为角膜再生提供仿生微环境。
(3)将RCSCs封装于生物墨水中,实现高存活率打印,体内外实验均显示凸面角膜显著减少纤维化,具临床转化潜力。
【EPTAC与I型胶原相互作用的模拟研究】
为深入探究EPTAC修饰对胶原分子的影响,本文通过模拟对比分析了EPTAC存在与否时胶原的相互作用特性。范德华力分析显示胶原体系与EPTAC-胶原复合物间的差异极小,证实静电相互作用为主导机制(图1d)。具体而言,胶原分子与水的作用力显著影响溶解性:添加EPTAC后,胶原-水分子相互作用能提升至4640.01×10³ kJ/mol(纯胶原体系为4636.04×10³ kJ/mol)。蛋白质-蛋白质对相互作用能在EPTAC-胶原体系中也略有增强。值得注意的是,总静电力变化趋势与蛋白质-水相互作用高度一致,突显了静电作用在两大体系中的主导地位。
如图1f所示,EPTAC通过静电力和范德华力与胶原分子结合,其中静电力强度超范德华力三倍以上(图1e),成为调控胶原溶解性的关键因素。在纯胶原体系中,胶原链内正负电区域的存在促使分子以头尾相接方式相互作用(分子间距0.5 mm)。而EPTAC结合负电区域后产生排斥效应,使分子间距增至5.1 mm,这种结构变化不仅增强了水合作用,还有效抑制了胶原聚集现象。
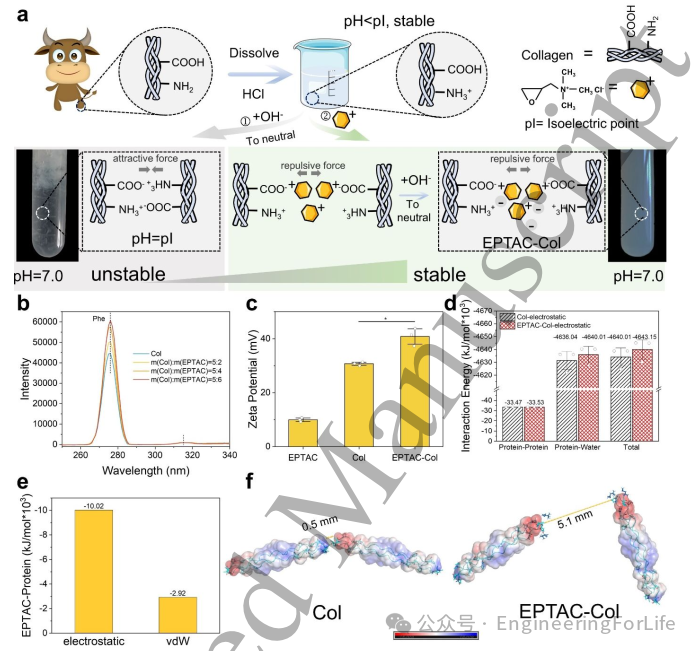
图1 胶原蛋白溶解性增强机制
【不同成分打印角膜的理化特性】
三维打印技术具有显著的精度优势。如图2b-c所示,生物凸面角膜打印体成功保持了完整的曲率结构,光学相干断层扫描(OCT)图像证实其厚度分布均匀。透明度是角膜再生材料的关键属性(图2d),打印角膜下方的文字仍清晰可辨,而纯GelMA样品展现出最优透光性(图2f),在750nm波长处透光率达90%。值得注意的是,随着EPTAC-Col浓度增加,透明度呈下降趋势——G7EC0.6组在750nm处的透光率为73%,与天然角膜(75%)相当。这种透明度降低现象与EPTAC-Col的添加直接相关,因其溶液本身呈现轻微浑浊特性,可能对角膜结构的透光性能产生不利影响。
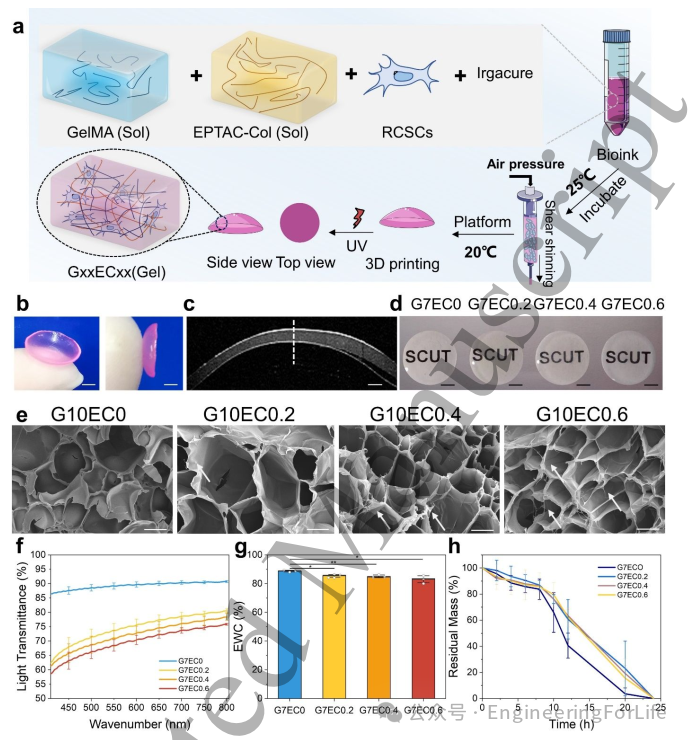
图2 不同成分3D打印生物角膜植入体的特性
角膜材料需承受眼内压及眼睑摩擦作用,必须具备足够的机械强度。EPTAC-Col的引入显著提升了材料的拉伸强度与断裂伸长率(图3a-c)。具体而言,G7EC0.6组的拉伸强度和断裂伸长率较纯GelMA提升约一倍,展现出更优的拉伸性能。虽然打印生物凸面角膜的拉伸强度低于天然角膜,但EPTAC-Col改性组的断裂伸长率与之相当——G7EC0.6组断裂伸长率达140%,甚至超越天然角膜(100%),证实打印角膜具备良好的柔韧性。
图3d应力-应变曲线表明,EPTAC-Col改性组可承受更大应力:纯GelMA最大应变仅50%,而G7EC0.6组可达70%。纯GelMA具有最高压缩模量(27kPa,图3e),因EPTAC-Col的加入会形成更柔软的网络结构,降低材料脆性,使GelMA/EPTAC-Col复合材料更具柔性。值得注意的是,图3e同时显示EPTAC-Col能增强纯GelMA的抗压缩能力。
通过循环压缩实验评估打印角膜在植入后承受眼睑反复挤压的稳定性。纯GelMA的应力-应变曲线重现性较差(图3g),应变超过10%后尤为明显;G7EC0.2组不仅曲线重现性下降,最大应力值也有所降低。相比之下,当EPTAC-Col浓度达0.4%-0.6%时,曲线重现性显著改善,偏移量极小,表明材料在循环压缩下更稳定。需特别指出,随着EPTAC-Col浓度增加,最大应力值呈下降趋势,这与观测到的压缩模量变化趋势一致。
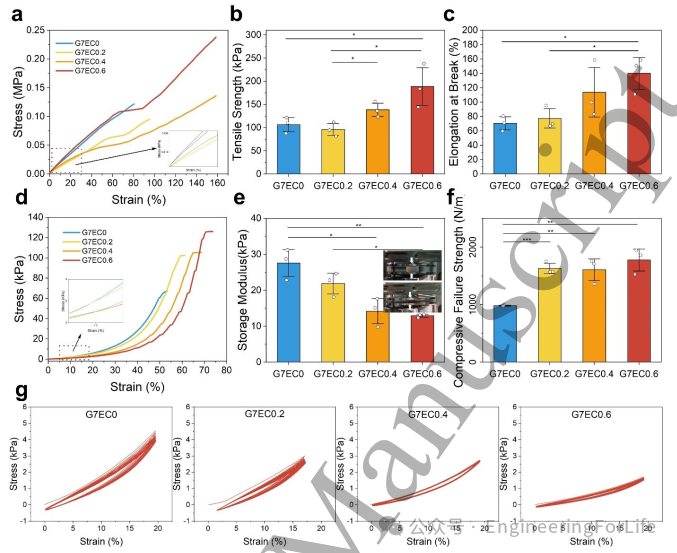
图3 不同成分3D打印角膜植入体的力学性能
【细胞活力与增殖分析】
细胞生物打印技术能够精准调控细胞分布,克服传统组织工程技术空间分辨率低的局限性。尽管过去几十年细胞打印领域取得显著进展,但制造具有高细胞活性和多功能性的器官仍面临挑战,主要源于打印过程中细胞承受的高应力。细胞损伤可能由剪切力、温度波动及辐射等多因素引发。此外,由于细胞被包裹在凝胶内部,其营养供给效率低于表面区域,可能影响后续细胞活力。
为评估打印生物凸面角膜内视网膜干细胞(RCSCs)的活力与增殖情况,本文在短期(1天)、中期(4天)和长期(10天)三个时间点进行检测(图4a)。各组活细胞数量无显著差异,且死细胞极少,表明打印角膜具有优异的生物相容性。三维重建显示RCSCs在各组内均匀分布,未出现团聚或密度不均现象,证实打印过程中重力未对细胞分布产生不利影响,且细胞在生物墨水内保持稳定,验证了所采用3D打印技术的可行性。
细胞活力分析(图4b)显示:培养首日活力最低,可能与细胞初始增殖动态有关;随着死细胞数量保持稳定而活细胞增加,存活率随时间推移上升。纯GelMA组活力最低(88%),含EPTAC-Col的组别活力均超过90%。至第10天时,纯GelMA组细胞活力达峰值98%,而EPTAC-Col组活力下降——这可能源于胶原蛋白的生物相容性初期提供了有利生长条件,但随着时间推移逐渐限制了细胞生长空间。
本文还检测了RCSCs在打印生物凸面角膜内的增殖情况(图4c)。结果显示细胞持续增殖,光密度值(OD)随时间递增,其中G7EC0.6组细胞活性最高。尽管增殖速率较慢,但RCSCs能在打印结构中良好生长(图4c)。材料力学性能与细胞生长的关系至关重要:已有研究表明过高材料强度会抑制细胞增殖,因此细胞组织工程通常优选中等强度材料以构建最佳生长环境。综合来看,G7EC0.6组在测试材料中展现出最优力学性能,细胞活性超过95%,表明其具备角膜再生材料的潜力,故被选为后续实验研究对象。
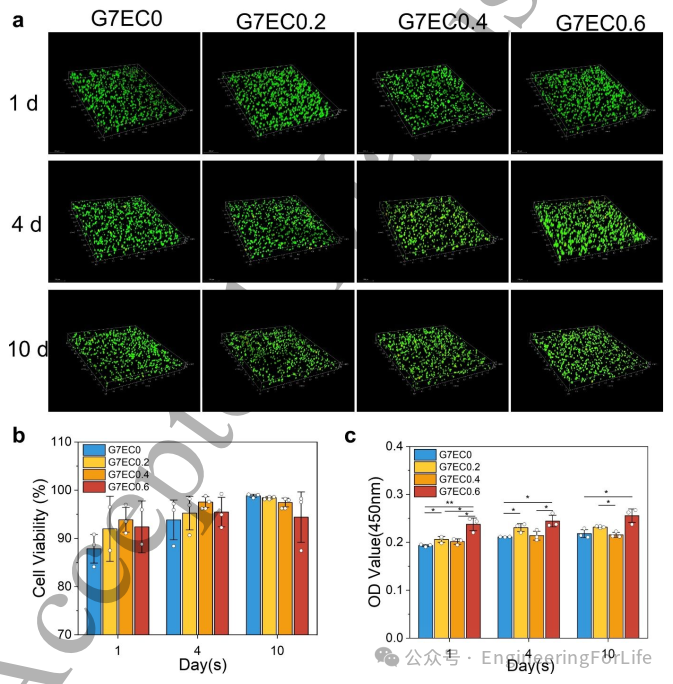
图4 不同成分3D打印生物凸面角膜在第1、4、10天的细胞存活率
【凸面角膜能维持角膜基质细胞表型】
鉴于基底拓扑结构可影响细胞行为和表达,本文首先对比了平面打印生物角膜与凸面生物角膜中RCSCs的形态差异。如图5a所示,H&E染色显示凸面角膜中的RCSCs呈现更细长的形态,并可见明显的细胞突起,而平面角膜中的细胞则呈圆形。这种形态差异源于细胞体积较小(100-200μm)且凝胶孔隙结构限制了细胞充分伸展。值得注意的是,平面结构中RCSCs难以维持表型,而凸面结构使细胞能感知并响应微环境,从而提升代谢活性和功能表达,这种相互作用促进了细胞与周围组织的整合及基本表型的维持。
培养第1天时,凸面角膜中V型胶原基因表达高于平面组,而α-SMA和COL3A1表达较低(图5b),提示凸面结构更利于维持RCSCs表型。平面组两种蛋白聚糖相关基因表达较高,推测是因培养时间较短,其中RCSCs与成纤维细胞仍处于动态转化过程,导致趋势不明显。至第4天,凸面组中两个成纤维细胞相关基因(α-SMA和COL3A1)表达下调,而三个RCSCs表型相关基因(V型胶原、角膜蛋白聚糖和基膜聚糖)显著上调(图5c),表明平面组RCSCs已基本转化为成纤维细胞,而凸面组成功维持了RCSCs特性。由此可见,凸面生物角膜在培养初期优势不明显,但能长期维持RCSCs功能表达并阻止其转分化,是优于传统平面三维培养的RCSCs体外培养模型。
作为潜在的角膜修复材料,该凸面结构不仅能体外维持RCSCs功能,植入体内后还可通过分泌蛋白聚糖、胶原等分子参与角膜原纤维的组装,从源头抑制角膜纤维化形成,展现出作为生物功能性角膜再生材料的应用潜力。
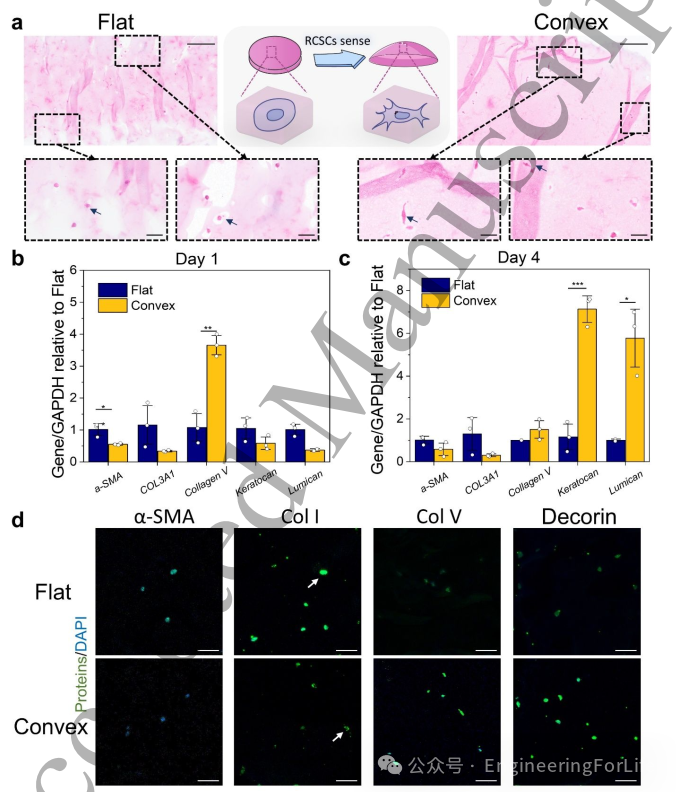
图5 3D打印平面/凸面组中RCSCs的表型与功能表达
【凸面角膜可抑制体内角膜纤维化】
研究设计兔基质层内角膜移植模型,验证3D打印凸面角膜能否抑制体内纤维化。设立四组实验:无细胞凸面打印角膜组、细胞负载的平面/凸面打印角膜组及仅制作囊袋的对照组。首组验证负载RCSCs的水凝胶是否更促进角膜再生,结果显示凸面组具有显著优势。实施基质层内移植时(图6b),可见打印角膜移植物易于操作且全程保持完整。持续观察42天后,无细胞组与凸面组角膜保持透明且上皮完整;而平面组在裂隙灯下第28天和42天出现明显纤维化(图6c)。这可能因为负载RCSCs的移植物经过14天体外培养,移植前已具备部分蛋白表达和功能活性。对照组因基质层缺损形成瘢痕,平面移植物可能诱发α-SMA表达,故出现纤维化。临床实践中基质层角膜移植术用于圆锥角膜治疗,角膜厚度是重要疗效指标。无细胞组移植物快速降解,角膜地形图显示厚度不均(图6d);平面组与凸面组移植物基本完整,角膜曲率平滑且厚度分布较均匀(移植后约500μm)。推测移植物内RCSCs通过再生过程中分泌胶原蛋白延缓材料降解,从而补偿降解损耗。
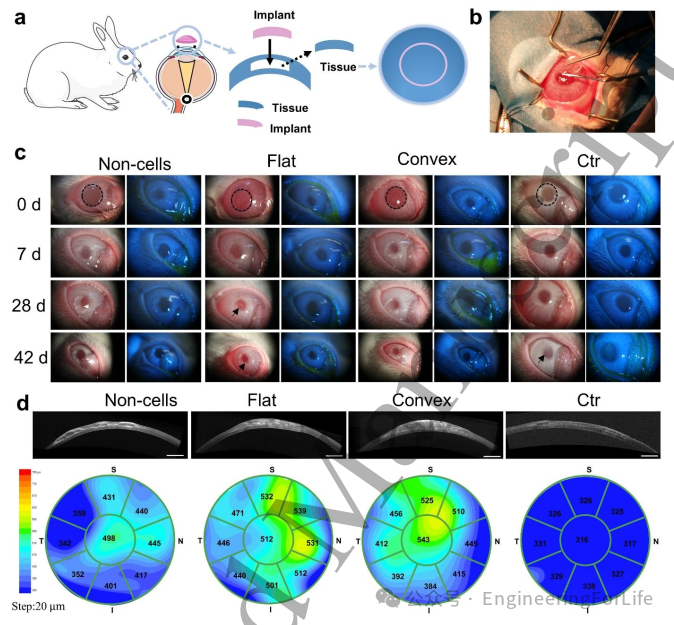
图6 兔角膜基质内移植术分析
通过H&E染色及角膜纤维化与基质再生相关蛋白表达分析,验证细胞负载凸面角膜是否可作为理想治疗移植物。图7a显示,部分炎症细胞侵入移植物-组织交界处,此现象可能加速移植物降解。细胞负载组移植物保持完整,可见具有伸展表型的负载细胞分布于移植物内部。值得注意的是,凸面组RCSCs周围存在大量再生ECM,该现象与V型胶原表达相关。无细胞组因缺乏细胞,未检测到特征蛋白表达。图7b显示凸面组V型胶原表达量显著高于平面组,其形成的聚集结构可能构成角膜基质主要成分。α-SMA作为角膜纤维化标志蛋白,在平面组明显表达(凸面组未检出),证实平面角膜可能诱发纤维化。综合上述结果,相较于常规平面设计,打印凸面角膜在抑制纤维化方面更具优势——不仅体内移植效果更佳,体外培养阶段RCSCs的功能活化对调控角膜纤维化转化亦起决定性作用。
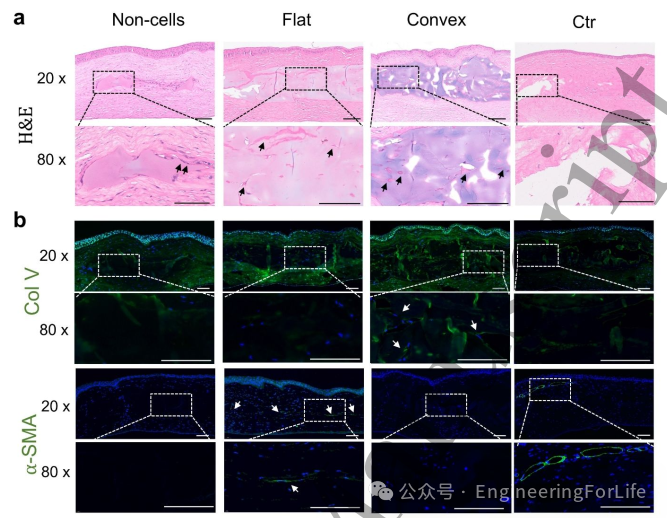
图7 术后42天不同处理组角膜的H&E染色与免疫荧光染色结果
【总结与展望】
本研究通过将RCSCs封装于打印角膜中,开发出具有高度仿生性和生物功能的角膜再生材料。研究主要聚焦两大方向:一是探索细胞负载生物打印技术,二是研究曲率调控RCSCs功能表达以抑制角膜纤维化。首先研制了适用于RCSCs的生物相容性墨水,确保细胞高存活率及成功打印;随后通过理化性能和生物学性能评估,证实打印的生物凸面角膜在角膜再生中展现出优异的应用潜力。鉴于拓扑形态影响细胞行为与功能表达的特性,本文进一步证实凸面角膜对RCSCs功能具有积极调控作用。与平面角膜相比,凸面角膜在体外实验中能从基因和蛋白水平抑制RCSCs向成纤维细胞转化。为验证凸面角膜的体内优势,构建了兔角膜基质内移植模型,通过大体观察和蛋白表达分析发现凸面角膜能显著减少体内角膜纤维化形成。这些结果表明,本研究打印的凸面角膜可作为理想的角膜植入物,在圆锥角膜等疾病的临床治疗中具有重要应用价值。
