CRISPR/Cas9,全称规律成簇间隔短回文重复序列/CRISPR相关蛋白9,是一种通过RNA引导Cas9核酸酶对外源遗传物质进行切割的细菌适应性免疫系统。以最常用的化脓性链球菌来源的SpCas9系统为代表,SpCas9核酸酶通过一个gRNA识别基因组中5’-NGG-3’的PAM区对特定的DNA靶位点进行切割,引起非同源末端连接(NHEJ)或同源重组(HR)DNA修复机制,实现对特定基因位点的编辑。目前基于CRISPR/Cas9的基因治疗方法已被成功用于多种单基因/多基因遗传疾病、肿瘤和病毒感染性疾病的基因治疗尝试,超过20种CRISPR/Cas9相关的临床治疗实验在陆续展开。但是,如何将CRISPR/Cas9高效递送到体内的细胞中进行基因编辑是目前亟待解决的问题。
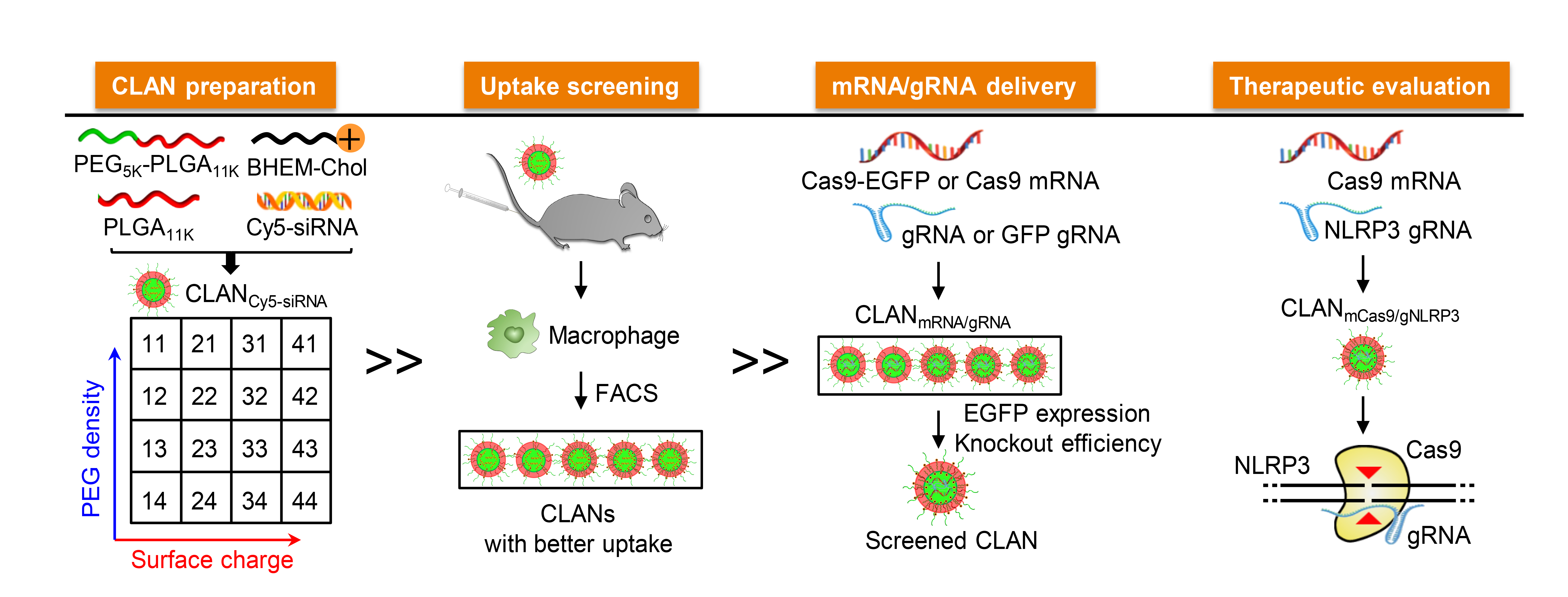
王均教授团队之前发展了一种基于FDA批准药用的聚乙二醇-聚乳酸(PEG-PLA)或者聚乙二醇-聚乳酸/乙醇酸嵌段聚合物(PEG-PLGA),通过掺入阳离子脂质,按照双乳化法制备的阳离子脂质辅助的聚合物纳米颗粒(Cationic Lipid-Assisted polymeric Nanoparticles, CLAN),通过CLAN纳米颗粒可以有效递送siRNA进入肿瘤细胞、T细胞和巨噬细胞等多种细胞发挥基因沉默功能。为了实现对CRISPR/Cas9的体内高效递送,王均教授团队对CLAN做了进一步的改进。首先,团队成员制备了一系列具有不同特性的CLAN纳米颗粒库,并通过体内筛选从中找到能够高效递送CRISPR/Cas9进入巨噬细胞的CLAN纳米颗粒。随后,王均教授团队利用筛选的CLAN纳米颗粒将Cas9 mRNA和靶向NLRP3基因的gRNA(mCas9/gNLRP3)高效递送到小鼠体内的巨噬细胞中,通过敲除NLRP3基因,抑制NLRP3炎症小体被多种炎症刺激剂活化,成功实现对小鼠败血症、腹膜炎以及II型糖尿病的预防或治疗。该研究成果找到了一种能够高效递送CRISPR/Cas9进入巨噬细胞进行基因编辑的纳米递送系统,为巨噬细胞功能干预和相关疾病治疗提供了新的技术手段,同时王均教授团队正在努力对CLAN做后续的改进,以解决针对更多细胞的体内CRISPR/Cas9递送难题。
2018年10月5日,该研究成果以“Targeting of NLRP3 inflammasome with gene editing for the amelioration of inflammatory diseases”为题在线发表在国际著名期刊Nature Communications杂志。论文的共同第一作者是许从飞博士和鲁紫东博士,通讯作者是王均教授,华南理工大学为论文的第一单位。该研究得到了科技部重大研发计划项目(2017YFA0205601)、广东省引进创新创业团队项目(2017ZT07S054)以及国家自然科学基金等项目的资助。
