学院边黎明教授、张琨雨教授团队在Nature Communications期刊上发表最新研究成果
近期,华南理工大学生物医学科学与工程学院边黎明教授、张琨雨副教授团队在国际学术期刊Nature Communications发表了以“Mechanically heterogeneous hydrogel with cell-programmed network restructuring promotes tissue regeneration by mechano-epigenetic modulation”为题的论文。华南理工大学为论文的第一署名单位,学院2022级博士生物医学工程专业凌强君、中山大学附属第一医院李昊医师为论文的共同第一作者,华南理工大学边黎明教授、张琨雨教授、赵剑阳副研究员和广东省人民医院骨肿瘤科主任张余教授为该文章的共同通讯作者。
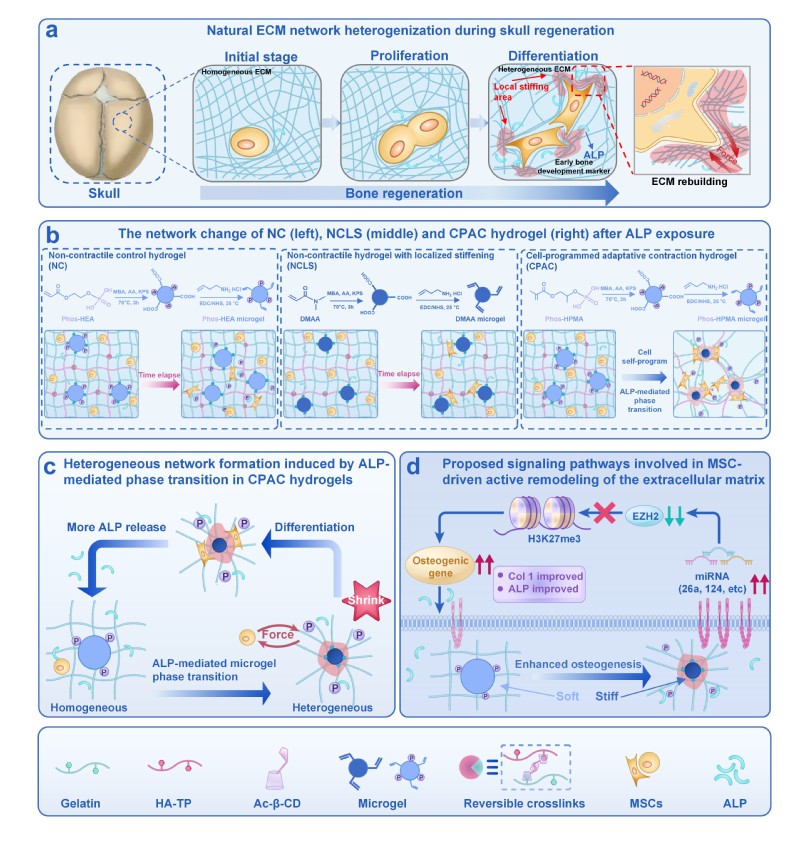
具有细胞编程网络重组的机械异质水凝胶(CPAC水凝胶)通过机械表观遗传调节促进组织再生设计示意图
在早期骨骼发育过程中,间充质干细胞(MSCs)在细胞外基质(ECM)的持续重塑中发挥着关键作用,这一过程对于引导其向成骨细胞分化并推动骨形成至关重要。未矿化的早期发育骨ECM交联程度松散,力学性质均一。随着发育的进行,细胞与ECM之间的动态相互作用,由于分子聚集和交联水平的增加,导致ECM逐步重构和成熟,从而将ECM转化为一种包含坚硬组分(如胶原纤维)和相对柔软成分(如多糖基质)的复杂异质结构。细胞分泌的酶等标记物对ECM的生化修饰驱动了这种动态重塑,并产生了空间上异质的ECM机械信号。这些信号在时间尺度上与细胞发育进程相匹配,对于调控干细胞命运具有决定性作用。
本研究开发了一种微凝胶集成水凝胶系统,它能够响应碱性磷酸酶(ALP,干细胞的一个关键早期成骨标志物)而演变为仿ECM的异质结构,称之为细胞编程自适应收缩(CPAC)水凝胶。不同于传统的静态微凝胶,这种磷酸酶响应性微凝胶被设计成可被封装其中的间充质干细胞(MSCs)分泌的ALP进行酶修饰,从而经历亲水-疏水转变和体积收缩,导致CPAC水凝胶发生仿生结构异质化并伴随局部网络硬化。这种细胞驱动的重塑紧密地再现了天然骨ECM的发育过程,并克服了以往人工硬化策略的时空局限性。该策略促进了封装MSCs的机械感知和成骨作用,从而进一步提高了ALP的表达,由此建立了一个通过机械转导增强成骨分化的正反馈循环。值得注意的是,细胞触发的水凝胶局部硬化改变了封装MSCs中与机械转导相关的微小RNA(miRNAs)的表达。这些机械敏感性miRNA靶向并抑制了关键组蛋白甲基转移酶EZH2的表达,从而降低了H3K27三甲基化(H3K27me3)水平,并增强了成骨基因的转录激活。CPAC水凝胶实现的这种机械转导-表观遗传耦合显著增强了MSCs的成骨定向以及大鼠临界尺寸颅骨缺损的原位愈合。本研究结果凸显了细胞驱动的生物材料适应性在建立时空协调的诱导性生物力学微环境中的至关重要性,该环境可用于引导有序编排的干细胞分化和组织再生。因此,CPAC水凝胶代表了从“静态ECM模仿”向“动态、细胞指令型生物材料”的转变,它整合了结构重塑和生物力学演变,以调控相互作用细胞的机械转导-表观遗传轴。(通讯员/张琨雨教授课题组)
文章链接:https://doi.org/10.1038/s41467-026-69004-z
