学院纳米生理学与医学团队在Nano Letters期刊上发表最新研究成果
近期,华南理工大学生物医学科学与工程学院蒋兴垭教授和华南理工大学附属第二医院杜步婕研究员在国际期刊《Nano Letters》发表了题为“Alloying Impacts In Vivo Behaviors of Ultrasmall Noble-Metal Nanoparticles through Intermetallic Charge-Transfer Mediated Ligand-Core Interactions”为题的论文。学院2025级生物医学工程博士研究生梁雅哲为本论文的第一作者,蒋兴垭教授、杜步婕研究员为该论文的共同通讯作者。
超小贵金属纳米颗粒在生物医学领域的应用前景广阔,尤其是在成像、药物递送和诊断等方面。通常认为超小贵金属纳米颗粒的表面配体是决定其体内行为的关键因素。近日,学院纳米生理学与医学团队报道了一个新发现,相同的表面配体,却因核心金属的合金化,使得超小贵金属纳米颗粒展现出截然不同的体内轨迹。该研究发现配体-核相互作用通过影响纳米颗粒表面电荷和蛋白质吸附来调节超小贵金属纳米颗粒的生物学行为,表明贵金属纳米粒子的金属核心组成是调节其纳米-生物相互作用的可调参数。

研究团队选择了超小尺寸的金纳米颗粒(AuNPs)、铂纳米颗粒(PtNPs)以及金铂合金纳米颗粒(Au/Pt AlloyNPs)作为研究对象。这些纳米颗粒表面均修饰有相同的配体——巯基琥珀酸(MSA),核心尺寸均小于3纳米,远低于肾脏的滤过阈值。在理论推测中,三种颗粒的表面化学几乎一致,它们在体内应表现出相似的行为,即主要通过单核吞噬系统识别表面MSA配体而被肝脏和脾脏摄取。然而,小鼠体内实验的结果出乎意料:单金属纳米颗粒MSA-AuNPs 和MSA-PtNPs 在肝脏和脾脏中大量蓄积,而MSA-AlloyNPs在这两个器官中的蓄积量分别降低了68%-86%和69%-90%。同时,MSA-AlloyNPs在24小时内的肾脏清除效率分别是金纳米颗粒的5倍和铂纳米颗粒的3倍左右。表明合金纳米颗粒能更有效地规避单核吞噬系统的捕获,通过尿液更快地被清除。
为了探究这种差异的原因,作者首先检测了纳米颗粒与血清蛋白的结合能力。结果发现,单金属颗粒与血浆蛋白的结合率高达88%-94%,而合金颗粒仅为39%。为什么表面配体相同,蛋白结合能力却有如此大的差异?通过红外光谱和X射线光电子能谱分析,作者发现,合金纳米颗粒中配体与核心的相互作用显著强于单金属颗粒。具体来说,巯基琥珀酸配体上的羧酸根基团与合金纳米颗粒表面金属原子的结合更强。这种增强的相互作用源于合金核心中的金属间电荷转移。由于金的电负性高于铂,在合金中,电子会从铂原子部分转移到金原子上,使得合金表面铂原子的正电性更强,从而与带负电的羧酸根基团产生更强的静电相互作用。
更强的配体-核相互作用带来了一个直接结果:纳米颗粒的表面电荷发生了改变。虽然三种颗粒表面都带有负电,但合金纳米颗粒的Zeta电位(-11.3 mV)明显高于金颗粒(-28.1 mV)和铂颗粒(-20.0 mV)。这表明,配体与核心的相互作用部分中和了表面羧酸根基团的负电荷。表面电荷是影响蛋白质吸附的关键因素之一。更接近中性的表面能够减少与血清蛋白的非特异性结合,从而降低被免疫系统识别清除的概率,促进肾脏清除。为了验证这一机制,作者合成了另一种表面只有一个羧基暴露的配体(β-巯基丙酸MPA)修饰的金颗粒作为对照。MPA-AuNPs的表面负电荷与MSA-AlloyNPs相似,其在体内的行为也与合金颗粒高度一致——低器官蓄积、高肾脏清除。这进一步证实了增强的配体-核相互作用降低了MSA-AlloyNPs的表面电荷。这反过来又介导了它们独特的蛋白质结合特征,并最终导致了它们与单金属纳米颗粒不同的体内行为。
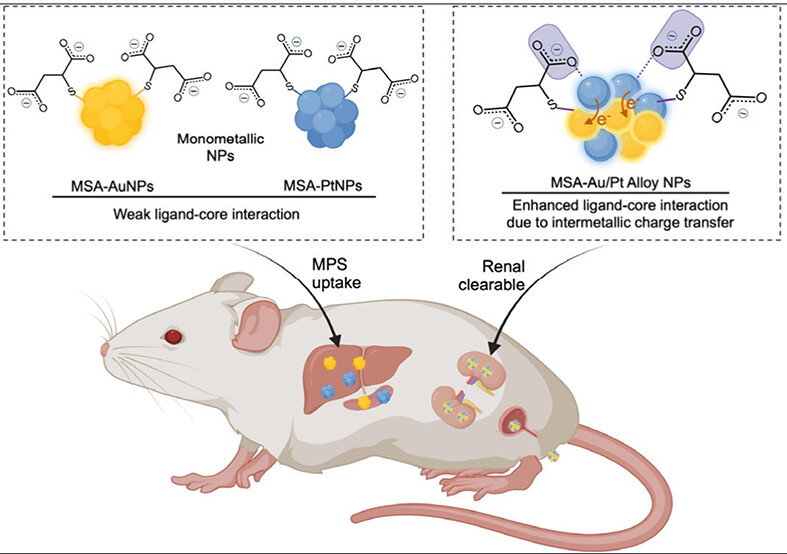
总之,本研究说明尽管包被相同的表面配体,核心合金化仍能显著改变超小贵金属纳米颗粒的体内行为。MSA-AlloyNPs的MPS逃逸效果是配体-核相互作用的结果,这种作用削弱了合金纳米颗粒的表面电荷,降低了它们对血清蛋白的亲和力,从而导致调理作用减弱和MPS识别减少。合金纳米颗粒中这种增强的配体-核相互作用源于从Pt原子向电负性更强的Au原子的金属间电荷转移,这使得合金纳米颗粒表面的Pt原子带正电更多,因此与单金属纳米颗粒相比,合金纳米颗粒才能更强烈地与MSA配体上带负电的羧酸根基团相互作用。此项研究突出了配体-核相互作用在调节NMNPs蛋白质结合和生物学命运中的作用,证明不仅表面配体,核心组成也能通过改变配体-核相互作用来影响纳米粒子的体内行为。(通讯员/蒋兴垭教授课题组)
文章链接:DOI:10.1021/acs.nanolett.5c05927
