学院边黎明教授、赵鹏超教授团队在Advanced Materials期刊上发表最新研究成果
近期,华南理工大学生物医学科学与工程学院边黎明教授、赵鹏超教授团队在国际学术期刊Advanced Materials发表了以“Enhanced biofilm infiltration by drug-laden coacervate for treating refractory infections”为题的论文。华南理工大学为论文的第一署名单位,生物医学科学与工程学院硕士毕业生王睿楠、中山大学附属第一医院李昊医师与易波博士为论文的共同第一作者,华南理工大学边黎明教授、赵鹏超教授和安徽大学杨雪峰教授为该文章的共同通讯作者。
细菌生物膜(Biofilm)是超过80%慢性感染的成因,其致密的细胞外聚合物网络结构严重限制抗菌药物的渗透,是导致感染迁延不愈和复发的重要原因。以金黄色葡萄球菌引起的骨髓炎为代表,感染区域不仅存在高致密度生物膜屏障,还伴随骨组织复杂的多孔结构,使得药物难以在感染部位实现充分浸润和持久滞留,成为制约顽固性细菌感染治疗的关键瓶颈。
针对上述挑战,团队提出:利用液-液相分离生成的凝聚体材料,凭借其超低界面张力(<0.5 mN/m)和独特的水不混溶性,能够像流体一样自主渗透进入微孔骨组织和致密生物膜内部,同时保持局部药物的高浓度滞留与缓释。基于上述假设,团队系统筛选了7种代表性凝聚体材料,从界面张力、黏度、生物膜浸润能力、生理稳定性和细胞相容性等多个维度进行对比评估。结果表明,界面张力低于0.5 mN/m的凝聚体可以显著突破生物膜屏障,而高界面张力凝聚体及水溶液体系几乎无法实现有效的生物膜浸润。
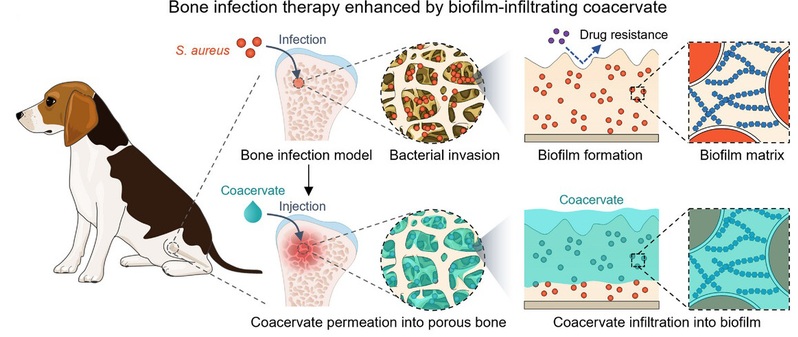
低表面张力凝聚体作为药物递送载体渗透生物膜用于骨髓炎治疗示意图
进一步研究发现,团队前期构建的PEG-alkyl 非复合凝聚体依托疏水作用与氢键驱动液-液相分离,在保持超低界面张力的同时,展现出优异的生理稳定性和生物相容性。该体系被确立为最优候选材料,并在小鼠和比格犬骨髓炎模型中得到系统验证,结果显示其能够深度渗透骨微孔与致密生物膜,实现药物在感染部位的长期滞留,高效清除金黄色葡萄球菌,显著抑制炎症反应并加速骨组织再生。综上,本工作将“低界面张力驱动的生物膜与组织浸润”作为一种凝聚体材料设计的新思路,为顽固性细菌感染的局部药物递送与治疗策略提供了新的材料学视角和潜在的可行路径。(通讯员/赵鹏超教授课题组)
文章链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/adma.202521500
