学院王均教授、杨显珠教授、沈松教授等在Advanced Materials期刊上发表最新研究成果
近日,华南理工大学生物医学科学与工程学院王均、杨显珠、沈松教授团队在国际材料科学期刊《Advanced Materials》上发表了题为“In Vivo Generation and Manipulation of CAR-T-mimicking Cells via Magnetic Bispecific Nano-antibody for Solid Tumor Therapy”的研究论文。华南理工大学为论文通讯单位,生物医学科学与工程学院2024届博士毕业生朱跃强(目前在广州医科大学工作)为论文第一作者,王均教授、杨显珠教授与沈松教授为共同通讯作者。
嵌合抗原受体T细胞(CAR-T)疗法在血液瘤治疗中已展示出成功疗效,但其在实体瘤治疗中仍面临肿瘤浸润不足和免疫抑制性微环境等关键挑战。传统CAR-T制备过程复杂、成本高昂,且易引起细胞因子释放综合征等副作用。近年来,体内T细胞工程策略受到广泛关注,其无需体外操作即可直接改造患者自身T细胞,但如何实现T细胞在实体瘤中的高效浸润与功能维持仍是难题。
本研究开发了一种名为“磁性双特异性纳米抗体(M-BiNanoAb)”的新型系统,可在体内将循环T细胞原位转化为具有CAR-T类似功能的效应细胞,并利用外部磁场引导其定向迁移至肿瘤部位,实现对实体瘤的精准高效治疗。M-BiNanoAb由β-环糊精功能化的磁性纳米颗粒为核心,通过超分子作用同时偶联抗CD3抗体和抗PDL1抗体。抗CD3部分可特异性识别并结合T细胞,模拟CAR结构中的信号激活域,启动T细胞活化;抗PDL1部分则模拟CAR的抗原识别域,靶向识别肿瘤细胞表面高表达的PDL1分子。
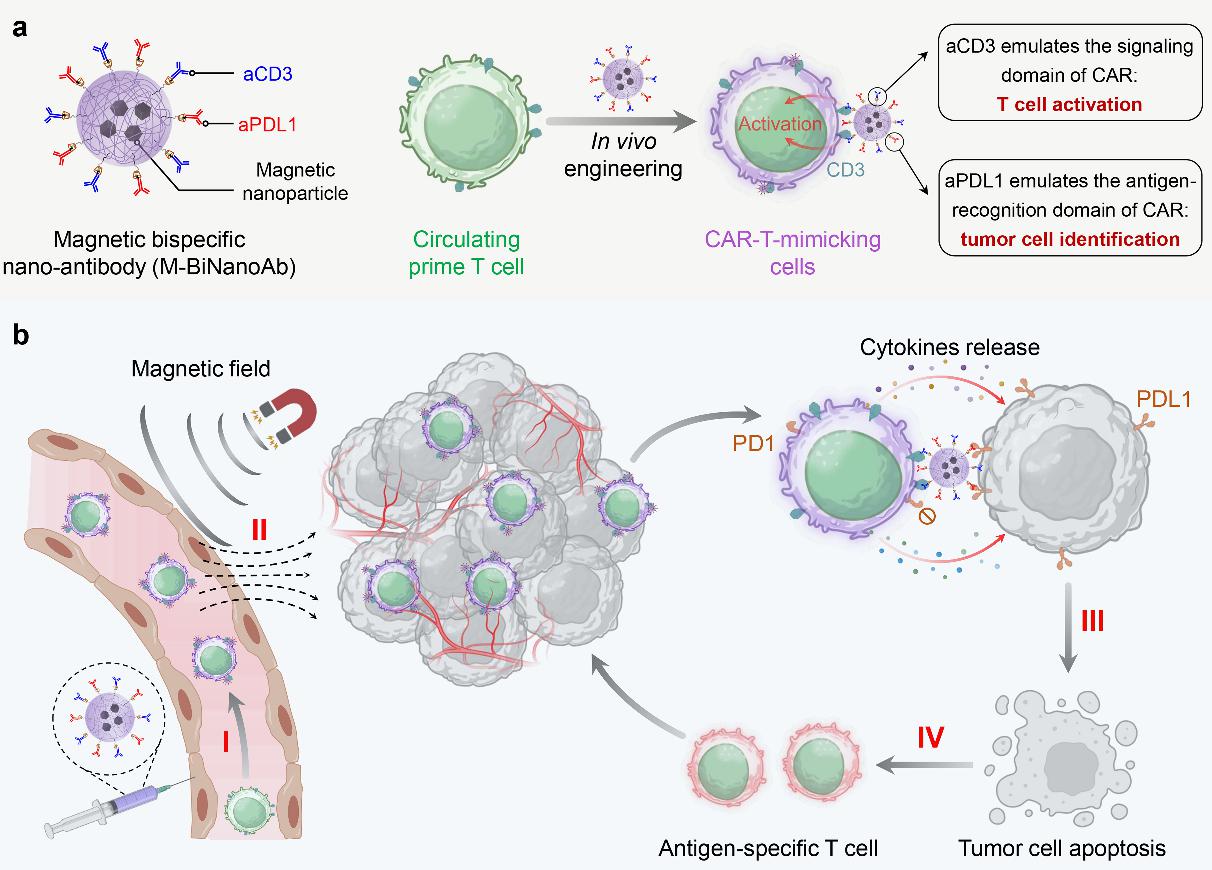
更重要的是,该系统中磁性纳米颗粒的引入使得工程化T细胞具备磁响应能力。在外部磁场引导下,CAR-T模拟细胞能够克服血流剪切力,实现向肿瘤组织的定向迁移与富集。在黑色素瘤(B16-F10)和三阴性乳腺癌(4T1)等多种实体瘤模型中,磁引导的M-BiNanoAb策略均显示出超过90%的肿瘤抑制率,并显著增强了肿瘤内CD8+ T细胞的浸润与活化。同时,表面携带的抗PDL1抗体可阻断PD-1/PD-L1免疫抑制通路,减轻T细胞耗竭,促进长效免疫记忆形成。
该研究提出了一种简单、高效的体内T细胞工程策略,通过模块化超分子组装与磁引导技术的结合,为克服实体瘤免疫治疗中的细胞浸润难、微环境抑制强等瓶颈提供了创新性解决方案。该平台具有高度的可扩展性,未来可通过替换不同靶向抗体适配多种肿瘤抗原,并有望拓展至自然杀伤细胞、巨噬细胞等其他免疫细胞的体内工程化改造中。(通讯员/杨显珠教授课题组)
