学院纳米医学和生物材料团队在Nature Communications上发表最新研究成果
近日,华南理工大学生物医学科学与工程学院王均教授/许从飞教授团队在Nature Communications上发表题为“Muscle-specific gene editing therapy via mammalian fusogen-directed virus-like particles”的最新研究成果。华南理工大学为该论文的第一署名单位,学院博士后周史焜、2024届药学硕士毕业生罗靖曈为共同第一作者,王均教授与许从飞教授为共同通讯作者。
肌肉组织在维持人体运动、姿态和平衡呼吸中发挥着至关重要的作用,其遗传缺陷往往会导致严重的疾病,如肌营养不良症。通过基因编辑修复突变基因,被认为是实现此类肌肉疾病根治的有效途径。然而,如何将CRISPR-Cas9等基因编辑工具精准递送至全身范围内分布广泛的骨骼肌细胞,始终是该领域面临的重大挑战。传统的腺相关病毒(AAV)载体虽然能够介导肌肉组织基因转导,但其长期表达、免疫原性较高以及潜在的脱靶效应等问题,仍限制了其在临床中的广泛应用。
针对这一瓶颈,该研究利用哺乳动物肌肉融合蛋白(Myomaker和Myomerger)构建了具有肌肉特异性膜融合能力的类病毒样颗粒(MuVLPs),实现了基因编辑工具在全身骨骼肌细胞中的精准递送,为杜氏肌营养不良症(Duchenne muscular dystrophy, DMD)等遗传性肌肉疾病提供了新的治疗策略。
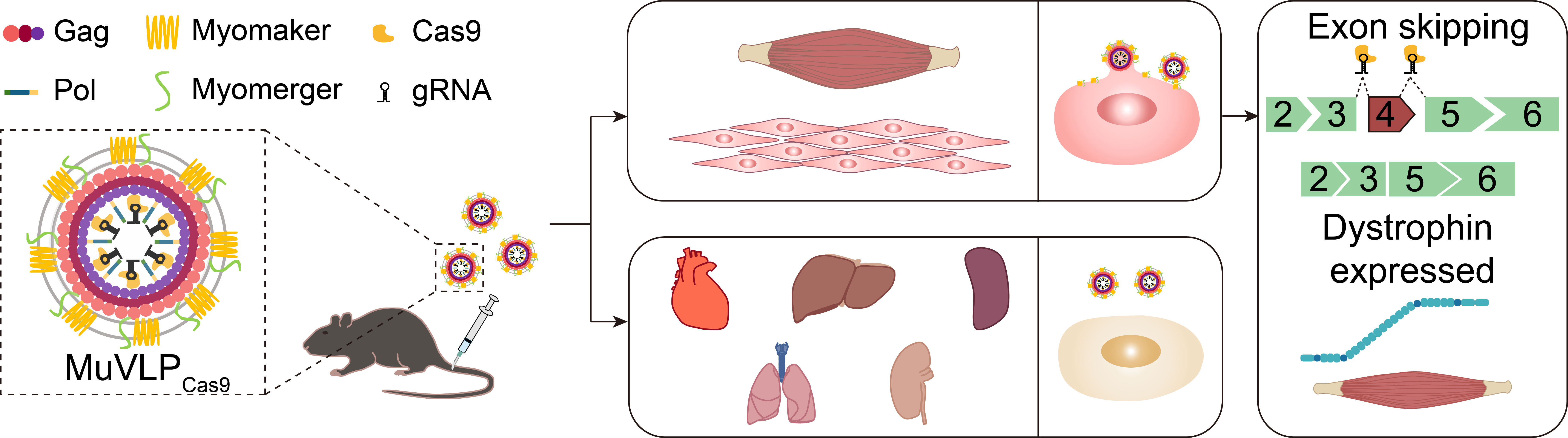
研究团队创新性地采用肌肉融合蛋白Myomaker和Myomerger对HIV-1病毒样颗粒进行表面工程化改造,构建出能够与骨骼肌细胞膜特异融合的MuVLPs平台。该系统可装载多种功能分子(包括EGFP、Cre重组酶以及Cas9/sgRNA核糖核蛋白复合物),并通过膜融合方式实现肌肉细胞内递送,而不引入外源基因组整合风险。研究结果显示,MuVLPs在体外仅能与表达肌肉融合蛋白的肌源性细胞融合,而在体内经静脉注射后,主要靶向骨骼肌,包括膈肌、股四头肌、胫骨前肌、腓肠肌与三头肌等部位。进一步的体内实验表明,将携带Cas9/sgRNA复合物的MuVLPCas9系统性注射至DMD小鼠模型,可特异性切除Dmd基因中致病的第4外显子,恢复骨骼肌中抗肌萎缩蛋白(dystrophin)的表达。经治疗的小鼠握力及跑步耐力均显著提升,血清肌酸激酶水平明显下降,显示出优异的治疗效果与生物安全性。该研究不仅建立了一种可实现肌肉细胞特异性膜融合递送基因编辑工具的新型治疗平台,还展示了通过哺乳动物自身融合机制实现精准递送的可行性。未来,该策略有望拓展至其他特定组织的基因治疗,为组织特异性基因编辑药物的研发提供新思路。(通讯单位/王均教授、许从飞教授课题组)
全文链接:https://www.nature.com/articles/s41467-025-64200-9
