学院石鹏教授团队在Advanced Materials期刊上发表最新成果
近期,国际学术期刊Advanced Materials发表了华南理工大学生物医学科学与工程学院石鹏教授团队以“DNA-Scaffolded Bispecific Antibodies Enhance Mesenchymal Stromal Cell Therapy for Inflammatory Bowel Disease”为题的论文。华南理工大学为论文的第一署名单位,学院2024级材料与化工博士研究生刘茜和学院博士后叶腾辉为论文共同第一作者,华南理工大学石鹏教授、中山大学附属第六医院张迪教授和黄小波主治医师为通讯作者。
炎症性肠病(IBD)是一类慢性胃肠道炎症性疾病,包括克罗恩病和溃疡性结肠炎。全球数以百万计的患者受炎症性肠病影响,疾病所致的生活质量下降和长期治疗需求也对社会经济造成了沉重负担。其核心发病机制在于免疫系统失衡——过度的白细胞归巢与浸润会导致肠道屏障受损,进而引发持续性炎症。因此,阻断白细胞向肠道的异常迁移被认为是缓解结肠炎症状、恢复肠道稳态的关键治疗策略。
间充质基质细胞(MSCs)因具备免疫调节、抗炎及组织修复等多重特性,被视为治疗IBD的有前景手段。然而,在体外扩增过程中,MSCs往往会丢失归巢相关分子,导致其迁移至炎症部位的能力下降,从而限制其治疗效果。已有研究表明,通过在MSCs表面修饰抗VCAM-1抗体可增强其与炎症血管内皮的黏附,从而改善其定向迁移性能。
基于此,华南理工大学石鹏课题组提出了一种创新的双特异性抗体-细胞偶联策略。研究团队利用DNA自组装技术,将促进MSCs靶向归巢的抗VCAM-1抗体与阻断白细胞归巢的抗MAdCAM-1抗体整合至同一DNA支架中,构建出具有双功能的抗体复合物。DNA支架可以确保抗体从细胞膜表面空间延伸,减少非特异性相互作用和空间位阻,进而保持抗体的高结合亲和力,同时避免了化学偶联所带来的异质性问题。
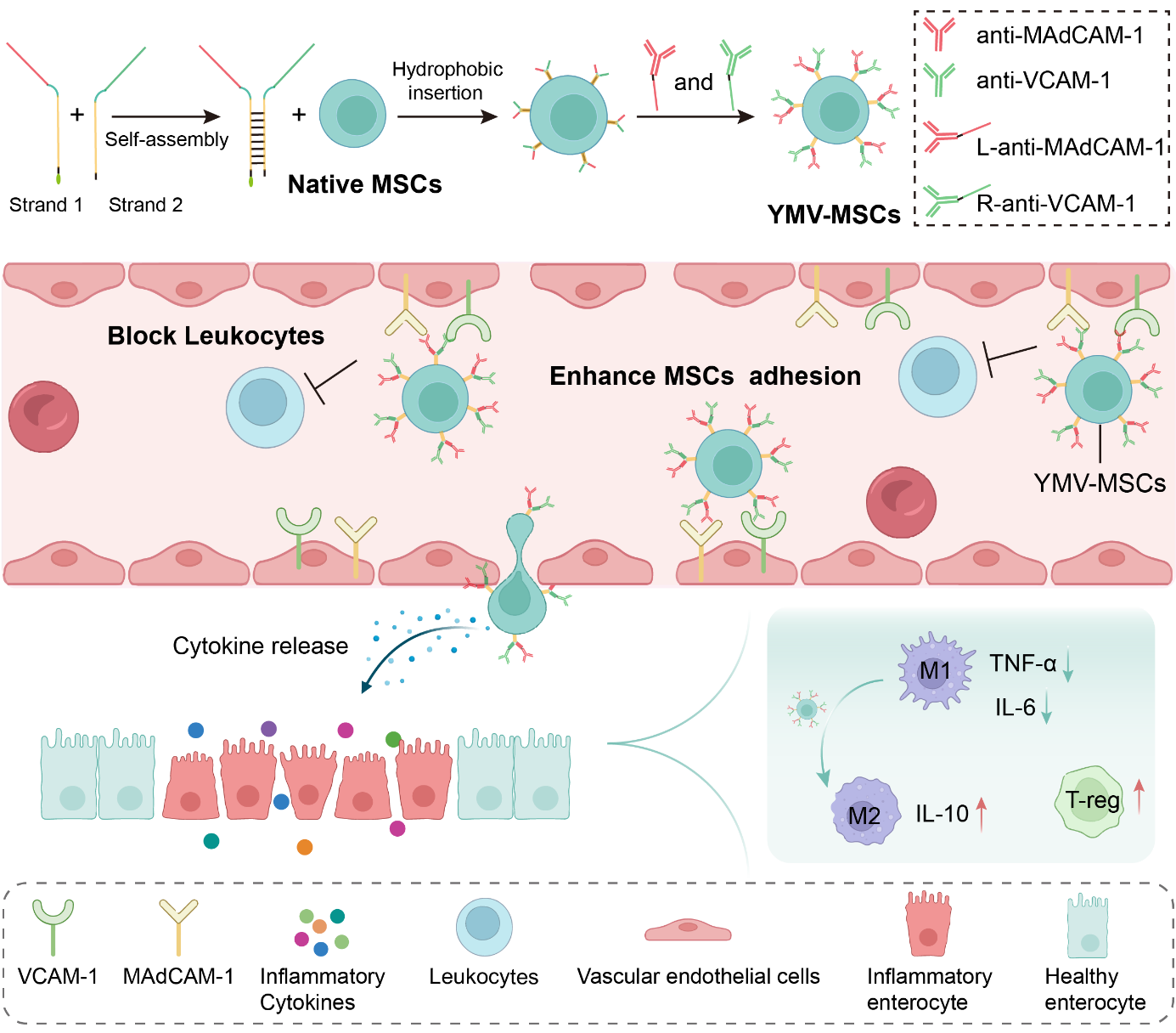
双特异性抗体工程化MSCs治疗IBD示意图
实验结果显示,双特异性抗体修饰的MSCs在体内外均表现出更强的内皮黏附能力,并能有效抑制白细胞在炎症血管上的黏附与聚集。在葡聚糖硫酸钠(DSS)诱导的急性结肠炎小鼠模型中,工程化MSCs显著降低了炎症部位白细胞的过度浸润,减轻了结肠组织炎症反应,促进了肠道屏障修复。总体而言,该研究提出的双特异性抗体-细胞偶联策略,通过同时增强MSCs的定向归巢能力并抑制白细胞异常迁移,为提升MSCs在炎症性肠病治疗中的疗效提供了全新的思路与技术路径。(通讯单位/石鹏教授课题组)
文章链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/adma.202511854
