刘洋教授团队在国际学术期刊Acta Biomaterialia发表重要综述
2025年7月31日,国际学术期刊Acta Biomaterialia发表了刘洋教授团队以“Inhalable nucleic acid therapeutics for chronic pulmonary disease: Progress,challenges,and prospects”为题的综述论文。华南理工大学为论文的第一署名单位,生物医学科学与工程学院2023级生物医学工程专业博士研究生王彦赓和2025级硕士研究生玄文哲为共同第一作者,广州医科大学毛成琼教授和华南理工大学刘洋教授为共同通讯作者。
慢性肺疾病(CLDs)如慢性阻塞性肺病(COPD)、哮喘、囊性纤维化(CF)和特发性肺纤维化(IPF)等,是全球主要的致病和致死原因之一,随着人口老龄化和环境污染加剧,其发病率和死亡率持续上升。这些疾病常伴随慢性炎症、气道重塑和肺功能进行性衰退,现有治疗多局限于缓解症状,无法从分子水平针对病理机制。核酸药物(如siRNA、mRNA、ASO、miRNA和适配体)具有精确调控基因表达、纠正突变和调控炎症或纤维化通路的潜力,但肺部递送面临多重生物屏障,如黏液清除、酶降解、巨噬细胞吞噬和细胞膜穿透等挑战,亟需开发高效的吸入递送系统。刘洋教授团队针对上述问题,系统综述了吸入式核酸药物递送平台的最新进展,强调通过纳米载体设计(如脂质纳米粒子、聚合物载体和混合纳米材料)来克服肺部微环境障碍,实现精准肺部递送和临床转化。这为慢性肺疾病的基因治疗提供了全面框架,并突显了其在呼吸系统疾病精准医学中的巨大潜力。
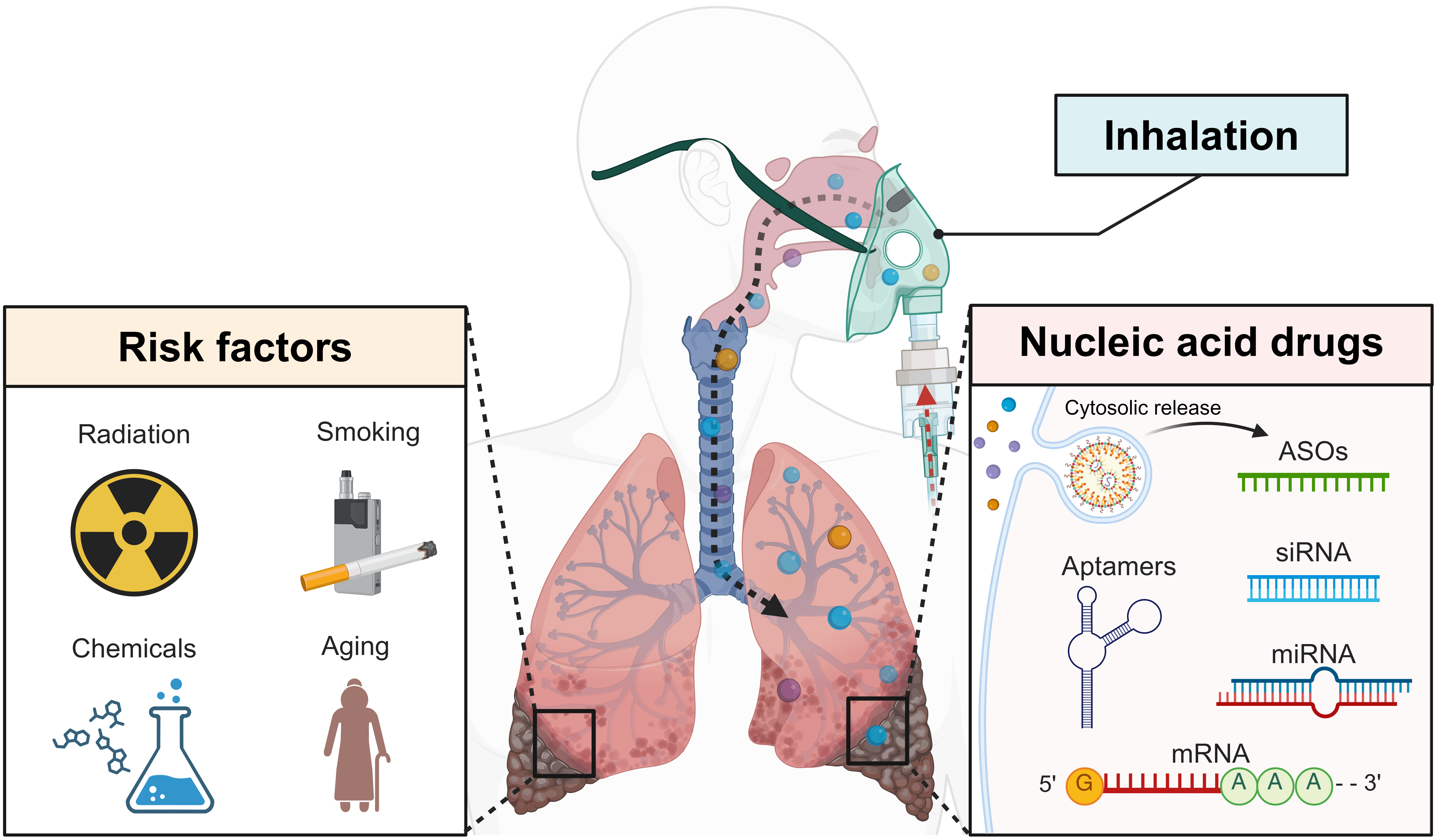
在该项综述中,研究团队首先分类并阐述了核酸药物的作用机制,包括ASO通过结合mRNA触发降解或阻断翻译,siRNA利用RNA干扰途径精确沉默基因,miRNA精细调控多个mRNA表达,mRNA编码功能蛋白实现瞬时表达,以及适配体高亲和力结合靶蛋白等。其次,突出了吸入递送的优势:肺部表面积达100 m²,直接非侵入式递送到位,绕过肝首过效应,实现局部高浓度、快速起效和低系统副作用,比静脉或口服路径更优(如生物利用度提高2-10倍)。然而,肺部屏障复杂,包括外细胞屏障(如黏液网和巨噬细胞清除)和细胞屏障(如内吞和溶酶体降解)。团队总结了应对策略:通过粒子大小(1-10 μm)、表面电荷和亲水性修饰(如聚乙二醇化)来提升载体稳定性、靶向性和转染效率;并讨论了病毒和非病毒载体(如脂质纳米粒子、金纳米粒子、树枝状聚合物和外泌体)的设计优化。此外,综述了针对四种疾病的科研进展:对于IPF,如siIL11@PPGC纳米粒子沉默IL-11表达抑制纤维化,scFv@iLNP-HP08LOOP递送mRNA编码IL-11中和抗体,mMMP13@RP/P-KGF纳米复合物降解ECM并修复肺泡,以及CYB5R3和BMP4 mRNA恢复线粒体稳态;对于CF,如β-谷甾醇富集LNP递送CFTR mRNA,SORT LNP实现CFTR基因编辑,PEG涂层DNA纳米粒子增强基因转染,临床上Eluforsen(ASO)改善F508del CFTR活性,MRT50(mRNA)显示初步安全性但疗效有限;对于COPD,如miR-21 antagomir抑制气道炎症,RPS3 siRNA阻断NF-κB通路减少炎症介质,TROP2 siRNA逆转基底细胞增生;对于哮喘,如ARO-RAGE(siRNA)I期临床试验降低sRAGE水平,siTSLP@Pep-LNPs抑制过敏性气道炎症。
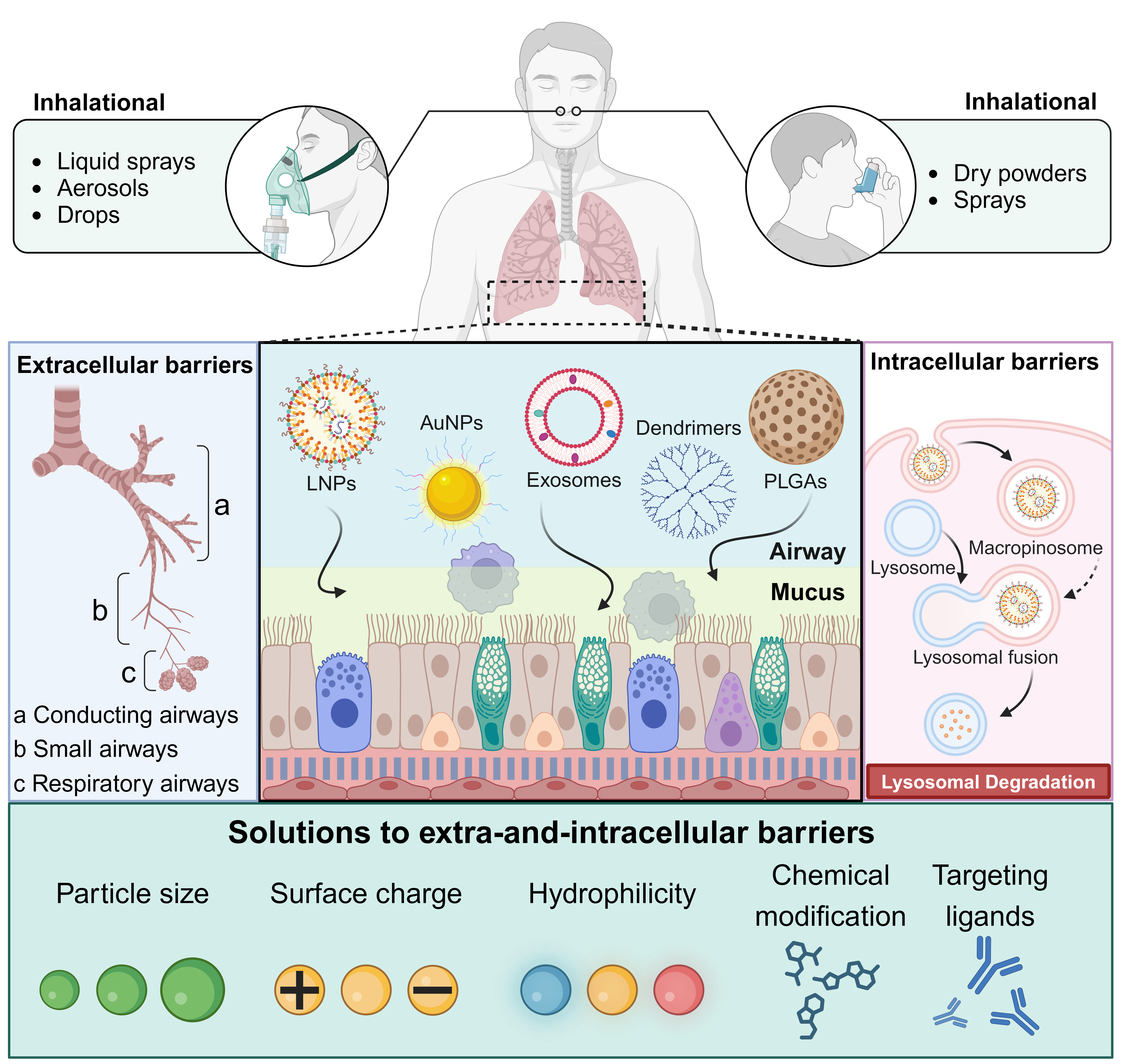
总体而言,本综述系统整合了核酸药理学与肺部药物递送科学的前沿进展,构建了吸入式核酸疗法的理性设计框架。通过强调纳米载体优化在肺部靶向递送中的关键作用,本研究不仅为慢性肺疾病的精准基因治疗提供了新的加速路径,也为包括癌症与感染在内的多类呼吸道相关疾病开辟了具有转化潜力的治疗策略。(通讯单位:刘洋教授课题组)
附文章链接(原文综述):https://doi.org/10.1016/j.actbio.2025.07.068
