学院纳米生理学与医学团队在 ACS Nano期刊上发表最新研究成果
活性氧(ROS)的过度产生是许多疾病发生和发展过程中常见的病理过程。因此,准确检测体内组织ROS水平可以为疾病的早期诊断和评估提供关键信息。化学发光分子在被ROS氧化时能够发射光子,这使得它们有望用于活体ROS水平的检测。然而,常见的化学发光化合物分子的发射波长短(通常仅为400-500nm),并且水溶性差,这两者都限制了它们在体内的使用。为了解决这些问题,化学发光分子通常被包裹在纳米颗粒中以增强亲水性,并通过化学发光共振能量转移(CRET)机制与其他发光染料耦合,将化学发光波长红移到更长的波长。然而传统的纳米颗粒包载策略会导致纳米颗粒尺寸偏大,且需要采用疏水性结构单元,这两方面因素都容易引起单核吞噬细胞系统(MPS,如肝脏)的积聚,并延缓体内清除速度,从而可能引发副作用。另外,生物组织中光穿透深度有限,使得无创化学发光成像对深层组织应用和临床转化具有挑战性。肾脏可清除光学探针有望绕过组织光穿透深度的限制,通过体外光学尿液分析实现对病理信号的远程检测。然而,目前的尿液光学探针通常依赖于单信号输出,容易受到尿液中探针浓度波动的影响,而尿液中探针浓度可能会因机体水份摄入量或疾病状态而有很大差异。因此,开发低MPS摄取和比率型信号输出的肾脏可清除ROS探针,对实现体内疾病信号的可靠检测十分重要。
基于此,华南理工大学纳米生理学与医学团队报告了一种基于化学发光分子ABEI偶联的超小近红外发光金纳米探针(ABEI-MSA-AuNPs),在通过电荷配对效应(Charge-pairing effect)实现体内极低MPS摄取和有效肾脏清除的同时,能够对体内病理ROS水平进行无创比率型成像与尿液检测,克服了目前化学发光纳米探针与人工尿液标志物的局限性。相关论文以“Charge-Pairing Enabled Renal-Clearable Chemiluminescent Gold Nanoprobes for Ratiometric Imaging and Urinalysis of Pathological Reactive Oxygen Species” (https://pubs.acs.org/doi/10.1021/acsnano.5c10143)为题,发表在国际学术期刊ACS Nano。

ABEI(N-(4-aminobutyl)-N-ethylisoluminol)是一种鲁米诺衍生物,可以与多种ROS分子反应并发出蓝光,是生理环境下ROS总体水平的良好报告分子。超小金纳米粒子MSA-AuNPs的斯托克斯位移较大,它能吸收蓝光并发射超过800 nm波长的近红外光。作者通过将带正电的ABEI分子化学偶联到表面带负电的MSA-AuNP上,构建了能够响应ROS并通过CRET效应发射近红外化学发光的ABEI-MSA-AuNPs。值得注意的是,单独的MSA-AuNPs和ABEI在体内均不通过肾脏代谢清除,然而将MSA-AuNPs和ABEI化学偶联后的ABEI-MSA-AuNPs则可以实现有效的肾脏清除,并且大幅减少了金纳米粒子在肝脏中的累积量,仅约为MSA-AuNPs肝脏累积量的百分之一。结合CRET效应以及ABEI化学发光与MSA-AuNPs光致发光对ROS的不同响应特性,在多种小鼠疾病模型上实现了通过无创比率型近红外活体成像或光学尿液分析来检测病理ROS水平。
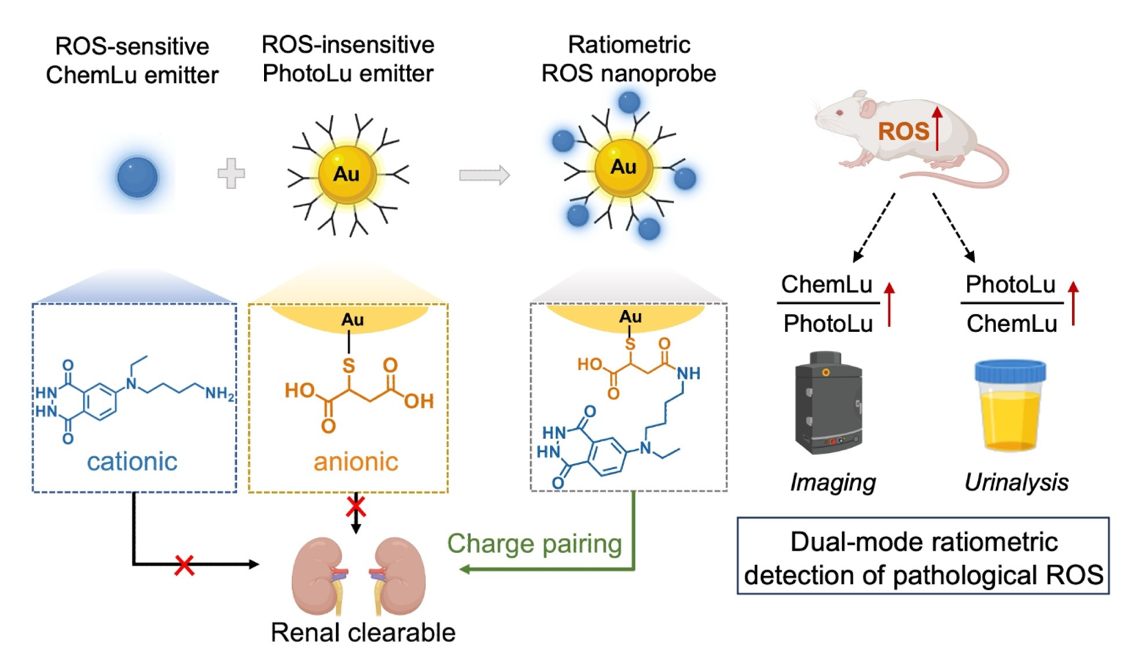
图:比率型探针的制备、体内行为、光学特性以及在活体检测病理ROS中的应用示意图
综上所述,本研究构建了一种超小尺寸、抗非特异性蛋白结合和高效肾脏清除的比率型化学发光纳米探针ABEI-MSA-AuNPs。该探针能够通过系统给药或局部给药与疾病组织中产生的ROS反应,并克服体内生物屏障将疾病处ROS信息带回到尿液中,规避了光学探针在组织穿透深度上的限制,实现通过比率型近红外活体成像或比率型光学尿液分析报告体内病理 ROS 水平,在早期检测ROS相关疾病方面显示出良好前景。该研究还凸显了构建肾清除纳米颗粒的电荷配对策略,即在高度带负电的超小纳米颗粒表面随机组装带正电荷配体(即使比例很小),可有效促进体内单核吞噬系统逃逸并实现肾脏清除。这一发现有望拓展可用于开发肾可清除纳米药物的配体库。
华南理工大学为论文的第一署名单位,华南理工大学蒋兴垭教授和华南理工大学附属第二医院杜步婕研究员为该论文的共同通讯作者,学院2022级化学专业硕士研究生刘洁墁和李想为本论文的共同第一作者。(通讯单位:蒋兴垭教授课题组)
