模拟细胞外基质组装,学院边黎明教授、赵鹏超教授团队设计液-液相分离“极简模型”
细胞外基质(ECM)通过液-液相分离和定向相变进行组装,是支撑生命活动的“动态脚手架”。ECM高度细胞适应性的非均质网络,高效指导包括铺展、增殖及力学感知在内的多种细胞行为。然而由于ECM多组分参与、多步骤组装的复杂性,当前人工合成基质难以有效模拟其天然结构及生物物理属性。
6月9日,华南理工大学生物医学科学与工程学院生物材料与再生医学研究团队设计开发了一种包含交替排列的疏水域和交联域构成的大分子“极简模型”,通过受控液-液相分离(LLPS)模拟ECM时空组装规律。相关研究成果在Nature Chemistry发表。文章第一作者为谢宪博士和李天杰博士,文章通讯作者为香港中文大学王一教授,华南理工大学生物医学科学与工程学院赵鹏超教授及边黎明教授。

一、自然启发的设计智慧
研究团队从弹性蛋白原的天然结构获得灵感(图1):这种ECM关键蛋白通过交替的疏水域与交联域实现“液滴形成→聚集→共价交联固化”的级联组装。基于此,团队构建了仅含两类元件的极简改性明胶大分子模型:
1.疏水调控:让相分离“收放自如”
通过调控明胶疏水基团的数量和相互作用强度,驱动明胶生物大分子液-液相分离,实现从液滴到宏观成熟凝聚体的精准调控。分子动力学模拟证实疏水基团形成π-π堆叠网络,驱动明胶大分子有序组装。
2.光控定型:锁定“液态记忆”
光敏交联域共价交联固化,实现凝聚体向水凝胶的精准转变。利用紫外光触发共价交联,将液滴瞬间“冻结”为水凝胶。形成的水凝胶完美保留相分离结构,形成刚(致密相)柔(稀相)并存的仿生网络。该设计模型通过控制相分离和随后的定向相变,紧密模拟了ECM弹性蛋白原凝聚步骤和共价交联介导的弹性蛋白纤维化。
研究团队介绍,“就像用乐高基础模块复刻复杂建筑,我们的研究首先要抓住ECM组装的本质逻辑。”
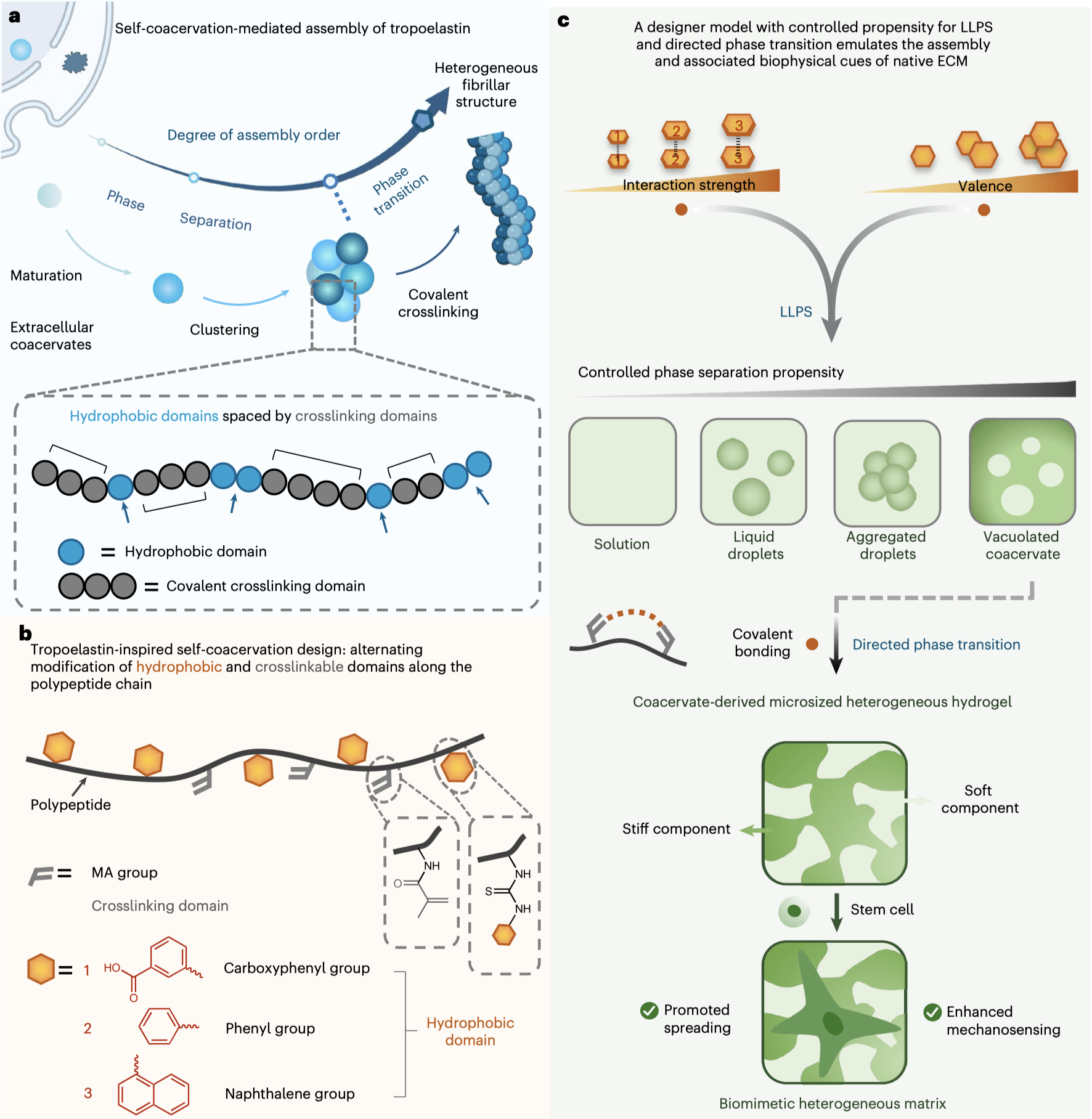
图1.受细胞外基质(ECM)结构蛋白启发,作者开发的能够模拟ECM时空组装过程及其相关生物物理特性的简约可控组装液-液相分离模型。
成熟坚固的弹性蛋白结构和其他坚硬的纤维ECM蛋白与松散包装的柔软多糖一起形成异质ECM,以促进细胞粘附和机械传感。具体而言,区域刚性网络提供锚定位点以支持细胞扩散、机械传感和其他事件。柔软的基质提供动态微环境以适应细胞发育。在研究团队的设计中,简约模型模拟了ECM的结构和关键形成步骤,包括交替域、液滴形成、聚结和共价交联,并最终形成由刚性框架和弱交联软区组成的仿生异质基质:
力学可编程:通过改变价数、相互作用强度和共价交联,相分离和随后的相变能够精确操控明胶大分子网络的力学性质,弹性模量调控范围跨越2个数量级。
仿生异质性:原子力显微镜(AFM)学测量证实,经过共价键介导的稳定化处理后,刚性框架和弱交联软微区模量差异达10倍,完美模拟天然ECM“软硬相间”结构。
赋能干细胞调控,重现天然ECM的重要生物物理线索:与均质水凝胶相比,具有局部硬化结构的凝聚体衍生的非均质水凝胶可以有效增强粘附干细胞的机械传感。首次证实液-液相分离衍生的结构异质性可直接调控干细胞命运。
科研团队设计极简模型灵感源自ECM弹性蛋白原的结构和组装过程,其特点是疏水部分和交联域交替排列。该设计无需添加任何添加剂即可实现自凝聚,仅需两步合成过程。所得凝聚体系在多种生理条件下均表现出优异的稳定性,拓展了其潜在应用。此外,通过改变疏水部分的价态和相互作用强度,进而诱导交联域的共价交联,我们可以模拟依赖于LLPS的蛋白质ECM结构的时空组装和成熟过程。更重要的是,所得相分离衍生水凝胶重现了天然ECM的微米级异质特性,并可作为仿生基质来调控干细胞行为,例如扩散和机械传感。我们相信,这种LLPS设计模型为阐明生物凝聚体介导的ECM组装和创造多功能仿生材料提供了有价值的工具。(通讯员/边黎明 赵鹏超教授课题组)
