华南理工大学纳米医学和生物材料团队在Advanced Materials杂志上发表最新研究成果
2025年5月9日,国际学术期刊Advanced Materials在线发表了纳米医学和生物材料团队以“Biomimetic Hybrid PROTAC Nanovesicles Block Multiple DNA Repair Pathways to Overcome Temozolomide Resistance Against Orthotopic Glioblastoma”为题的论文。华南理工大学为论文的第一署名单位,2022级生物医学工程博士研究生徐清和2022级生物医学工程硕士研究生胡翔宇为论文的共同第一作者,袁友永教授为论文的通讯作者。
胶质母细胞瘤(GBM)是中枢神经系统中高度恶性肿瘤,具有高死亡率、高复发率和预后差的特点。尽管综合治疗手段不断进步,但胶质母细胞瘤患者的五年生存率仍然很低。替莫唑胺(TMZ)作为GBM的标准化疗药物,能够穿过血脑屏障,通过诱导DNA链烷基化发挥细胞毒性作用。然而,肿瘤细胞内多种DNA修复机制的激活会削弱TMZ的疗效,导致化疗耐药和肿瘤复发。近年来,研究发现溴结构域蛋白4(BRD4)在GBM组织中的表达显著升高,并与总生存期呈负相关。此外,BRD4在多种DNA损伤修复途径中起关键作用,如O6-甲基鸟嘌呤-DNA甲基转移酶(MGMT)、非同源末端连接(NHEJ)和同源重组修复(HR)等。因此,针对BRD4的治疗可能成为克服TMZ耐药性、改善GBM患者预后的有效策略。
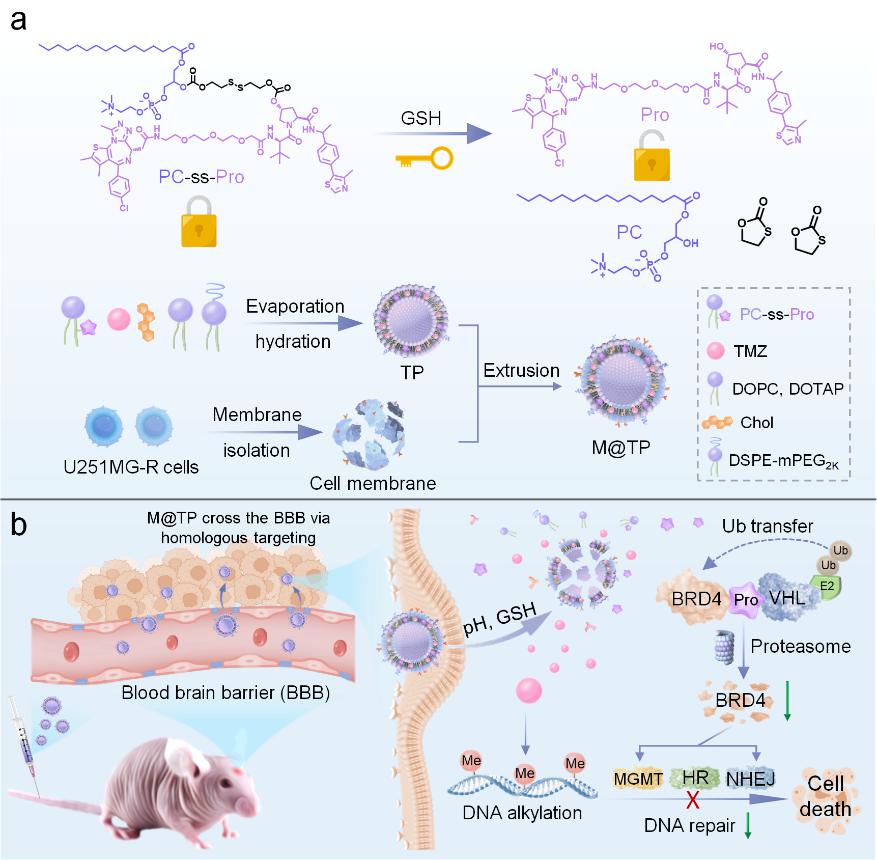
示意图:(a)PC-ss-Pro的GSH响应激活和M@TP制备的示意图。
(b)M@TP 通过降解BRD4阻断多种DNA修复途径逆转TMZ耐药的示意图。
目前,虽然已开发出多种小分子BRD4抑制剂,但其临床应用常因药物耐受性、高剂量给药导致的毒副作用以及血脑屏障的限制而受到阻碍。蛋白降解靶向嵌合体(PROTAC)技术通过连接靶蛋白配体和E3泛素连接酶配体,利用细胞内的泛素-蛋白酶体系统实现靶蛋白的快速降解,克服了传统小分子抑制剂的局限性。然而,PROTAC分子量大、细胞渗透性差且缺乏肿瘤靶向性,限制了其在GBM治疗中的应用。为解决这些问题,研究团队开发了一种仿生杂化PROTAC纳米囊泡(M@TP),旨在克服TMZ的耐药性。通过将谷胱甘肽(GSH)响应的BRD4降解剂(PC-ss-Pro)和TMZ制备成脂质体,并利用TMZ耐药胶质瘤细胞膜进行融合伪装,以实现跨血脑屏障和对GBM细胞的主动靶向作用。M@TP在酸性和高水平的GSH环境下可释放TMZ和Pro,Pro通过降解BRD4,阻断多种DNA修复途径,恢复肿瘤细胞对TMZ的敏感性。体内外实验表明,M@TP能有效抑制TMZ耐药和术后GBM的生长,延长小鼠生存时间,为克服TMZ耐药和改善GBM的预后提供了新策略。(图/文 袁友永教授课题组)
文章链接:
https://advanced.onlinelibrary.wiley.com/doi/full/10.1002/adma.202504253
