学院纳米医学和生物材料团队在Advanced Materials发表最新研究成果
2025年4月28日,国际学术期刊《Advanced Materials》在线发表了华南理工大学纳米医学与生物材料研究团队的最新研究成果,论文题为《Phagocytosis-Activating Nanocomplex Orchestrates Macrophage-Mediated Cancer lmmunotherapy》。学院2022届博士毕业生黄华和童其松为论文的共同第一作者,医学院杜金志教授与生医学院沈松副教授为论文通讯作者。论文得到王均教授的指导和大力支持以及科技部、基金委对相关项目的资助。
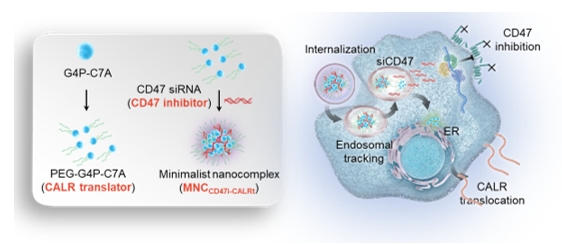
图1. MNCCD47i-CALRt同步调控“吃我”与“别吃我”信号,增强巨噬细胞吞噬能力
肿瘤相关巨噬细胞(TAMs)作为肿瘤微环境中含量丰富的一类免疫细胞群,在肿瘤的发生发展、浸润转移、血管生成及免疫逃逸等过程中发挥着关键调控作用。随着对TAMs功能的深入研究,靶向TAMs以增强其吞噬肿瘤细胞的能力已成为肿瘤免疫治疗领域的重点研究方向。肿瘤细胞通过高表达“别吃我”信号CD47,与巨噬细胞表面SIRPα结合,减弱TAMs的吞噬作用,逃避免疫系统监视和清除。然而在许多实体瘤中,仅阻断CD47- SIRPα这条通路不足以发挥足够的吞噬清除和抗肿瘤作用,这是由于除了“别吃我”信号,巨噬细胞吞噬功能还受到“吃我”信号的调控。这类“吃我”信号往往在肿瘤细胞上表达较低,如何同时调控两条通路对促进TAMs吞噬至关重要。
基于此,研究团队研发了一种由PAMAM衍生物(G4P-C7A)与CD47 siRNA复合形成的极简纳米复合物MNCCD47i-CALRt,能够同时调节肿瘤细胞上的“吃我”(CALR)和“别吃我”(CD47)信号,突破了抗吞噬信号上调和促吞噬信号不足的限制。通过这种双重调控,MNCCD47i-CALRt显著增强了巨噬细胞对肿瘤细胞的吞噬作用。研究证实MNCCD47i-CALRt能够显著延缓肿瘤生长,延长荷瘤小鼠的生存时间,且几乎无造血毒性。此外,MNCCD47i-CALRt的促吞噬能力在人类结直肠癌细胞和患者来源的肿瘤类器官模型中得到了验证。这项研究提供了一种基于巨噬细胞功能调控的肿瘤免疫疗法,有望为肿瘤免疫治疗领域提供新策略。(通讯员/学院纳米医学和生物材料团队)
