纳米生理学与医学团队在 ACS Nano期刊上发表最新研究成果
肝脏作为体内重要的新陈代谢和解毒器官,能够通过生物转化过程对内源性和外源性物质进行化学修饰,以促进其排泄。先前的研究发现,肝窦中高浓度的生物硫醇(谷胱甘肽等)可以在纳米粒子到达靶点之前过早地诱导功能性或靶向性配体从金纳米粒子表面解离,这对于依赖于功能配体发挥作用的金纳米粒子是一个重要的生化屏障。因此,开发一种能够有效控制肝脏谷胱甘肽介导的纳米粒子生物转化策略对于克服这一体内生化屏障至关重要。
基于此,华南理工大学“纳米生理学与医学”研究团队使用硒代谷胱甘肽(GSeH)作为金纳米粒子(AuNPs)的表面配体,合成了GSeH保护的Au25纳米粒子(Au25(SeG)18),进一步将ICG连接到Au25(SeG)18纳米粒子的表面,得到了ICG-GSe-Au25,这种纳米粒子可以像团队先前所报道的ICG-GS-Au25纳米粒子一样特异性地靶向到肝脏。研究团队研究发现,与ICG-GS-Au25相比,改变配体键合模式从Au-S到Au-Se键显著降低了Au25纳米粒子的肝窦生物转化,能够使ICG介导的金纳米粒子对肝实质细胞的靶向性显著性增加,并在肝脏中具有明显不同的细胞分布情况。同时,键合模式的改变也进一步影响了金纳米粒子在肝内的转运过程,导致纳米粒子体内清除途径从肾脏途径切换到肝胆途径。此外,该团队还证明了Au-Se键合策略可以显著增强金纳米粒子在富含生物硫醇的环境中的疾病组织主动靶向能力(例如,肝脏中的肿瘤)。
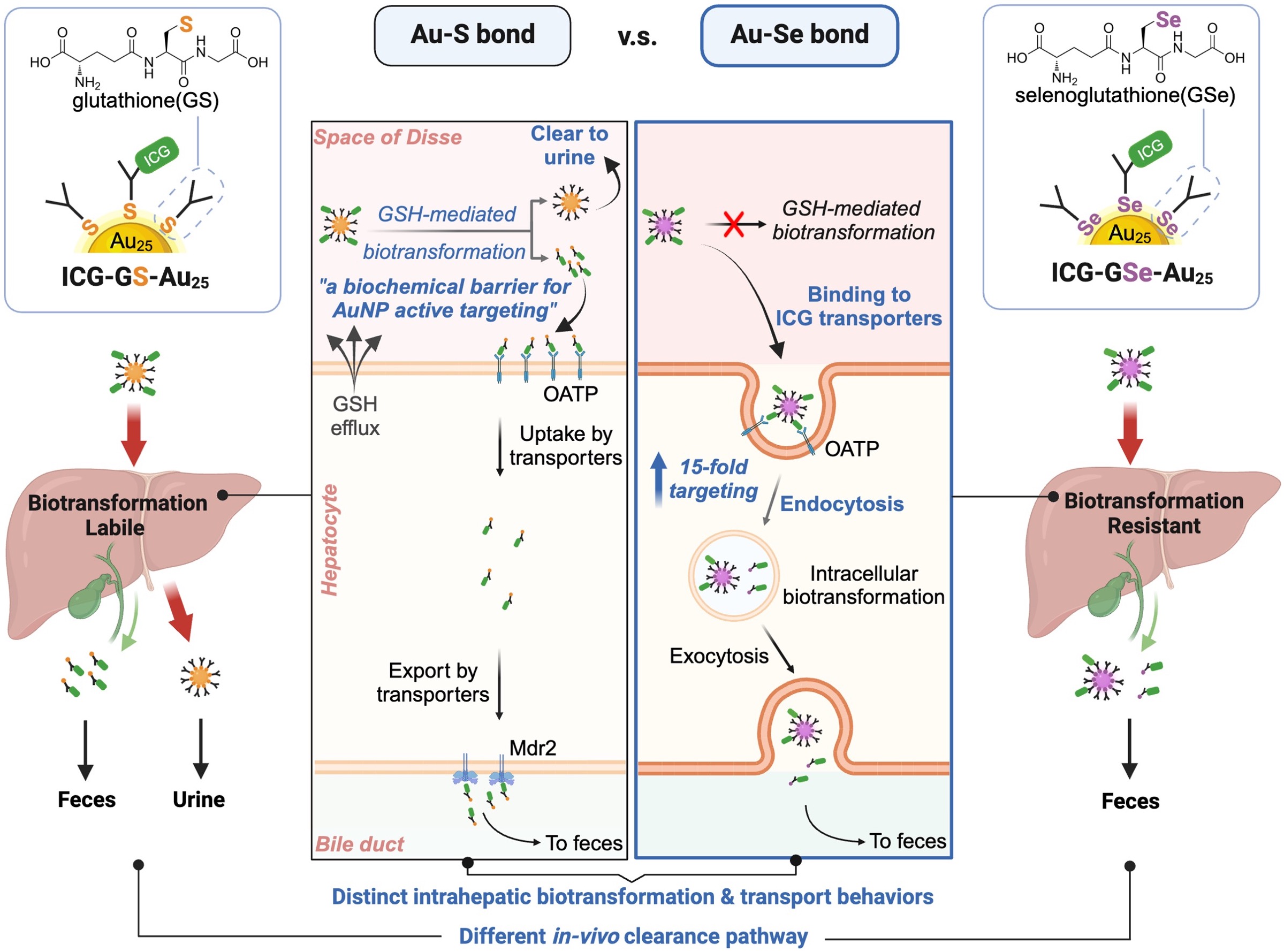
图:金属-配体键(Au-S 与 Au-Se)如何影响两种金纳米粒子的肝脏生物转化和体内运输的示意图
此研究不仅拓宽了对纳米粒子体内生物转化过程的理解,而且提供了一种可行的策略来调节这个重要的生理过程,以便精确地调控相关纳米粒子的体内运输和靶向行为,为相关纳米药物的设计和优化提供了新的机遇。
研究成果近期以“Overcoming Hepatic Biotransformation Barrier of Gold Nanoparticles via Au-Se Bond for Enhanced In Vivo Active Targeting” (https://doi.org/10.1021/acsnano.4c10700)为题发表在国际权威学术期刊ACS Nano上。华南理工大学为论文的第一署名单位,团队2022级博士研究生卢辉旭为论文的第一作者,华南理工大学生物医学科学与工程学院蒋兴垭教授和华南理工大学附属第二医院杜步婕研究员为论文的通讯作者。(通讯员/蒋兴垭教授课题组)
