学院纳米医学和生物材料团队在Nano Letters上发表最新研究成果
在过去几十年中,基于核糖核酸(RNA)的治疗策略,包括信使RNA(mRNA)、小干扰RNA(siRNA)以及其他类型的RNA分子,在治疗病毒感染、癌症、遗传性疾病和传染病方面取得了显著成就。不同类型的RNA可通过抑制、替换、增添或编辑基因表达,有效地调控与疾病相关的基因。目前,多项基于RNA的治疗方法正在进行临床试验,旨在治疗多种严重疾病。然而,值得注意的是,RNA的有效递送仍是这些治疗策略成功的关键瓶颈,原因在于RNA的快速清除、易降解性以及细胞内化的困难。目前,除了GalNAc-siRNA复合物外,仅有脂质纳米颗粒(LNPs)被批准用于mRNA和siRNA的递送,然而LNP和GalNAc偶联物都主要积累在肝组织中。因此探索核酸非肝脏传递系统,充分发挥RNA在疾病治疗中的潜力是一个迫切的愿望。
本研究旨在探索一种通用的RNA递送策略,通过RNA的疏水化处理及其与两亲性聚合物的共组装,实现高效的非肝脏递送。具体而言,RNA通过与阳离子脂质DOTAP和可电离脂质DLin-MC3-DMA的相互作用进行疏水化,随后与两亲性聚合物mPEG-b-PLGA共组装,以实现高效的RNA封装。在此配方中,DOTAP在RNA疏水化过程中发挥主导作用;DLin-MC3-DMA促进RNA在细胞内的快速逃逸;而mPEG-b-PLGA则有助于稳定疏水性RNA,形成胶束状纳米颗粒(MNPs),适用于全身静脉注射。此疏水化RNA策略适用于siRNA、mRNA和质粒等多种核酸。静脉注射MNPs后,封装的靶向PD-L1或CD47的siRNA能有效富集于肿瘤组织,阻断关键的免疫检查点,从而引发强烈的抗肿瘤免疫反应。此外,肌肉注射MNP封装的肿瘤抗原mRNA显著增强了疫苗的MHC I类呈递,并诱导大量抗原特异性CD8+ T细胞的产生,有效抑制肿瘤生长。
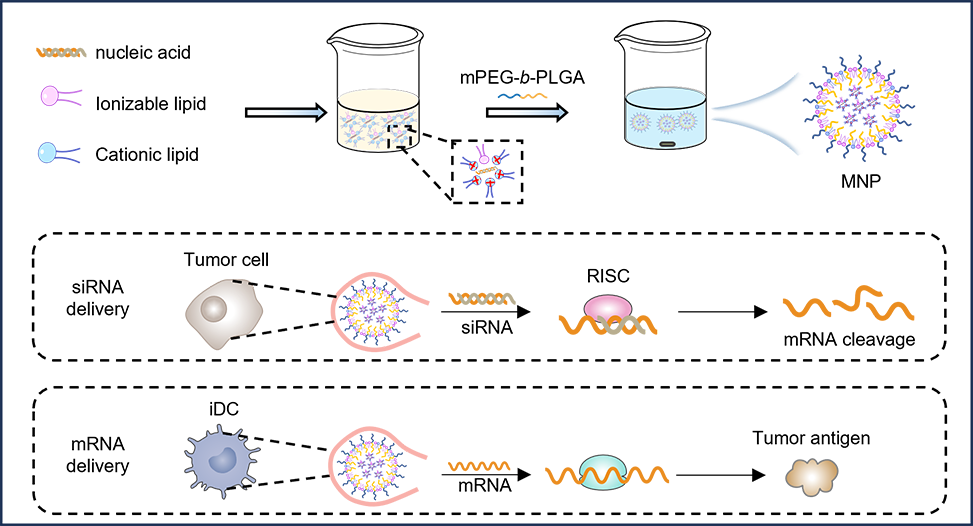
研究成果以“Hydrophobization of Ribonucleic Acids for Facile Systemic Delivery and Multifaceted Cancer Immunotherapy”为题发表在国际权威学术期刊Nano Letters上。张玉喜、陈超然为论文的第一作者,华南理工大学杨显珠教授、上海市第四人民医院李成副教授与广州市第一人民医院王俊侠副研究员为论文的通讯作者,华南理工大学为论文的第一署名单位。(通讯单位:纳米医学和生物材料团队)
