华南理工大学付晓玲团队与南开大学王恺/孔德领合作发表最新研究成果
学院付晓玲教授团队与南开大学王凯教授/孔德领教授团队合作,在基于干细胞来源工程化纳米囊泡治疗血管损伤方面取得重要进展,研究成果以 “Enhanced Targeted Repair of Vascular Injury by Apoptotic-cell-Mimicking Nanovesicles Engineered with P-Selectin Binding Peptide” 为题于2024年9月10日在国际学术期刊Advanced Functional Materials上发表,张睿心和闫顺顺为论文的共同第一作者,付晓玲、王凯和孔德领为论文的通讯作者。
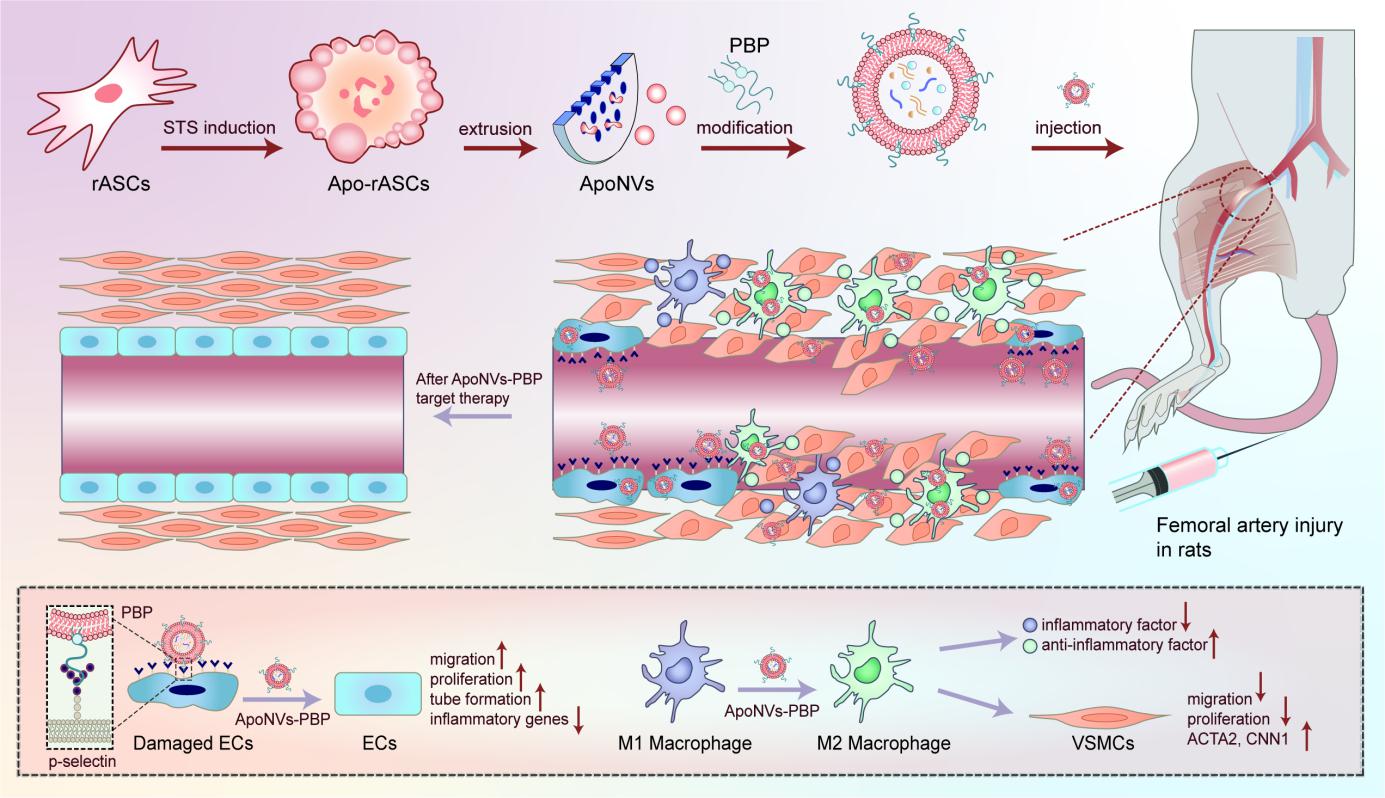
图1. ApoNVs-PBP有效抑制炎症,显著降低损伤部位的血流速度和新生内膜增生靶向治疗血管损伤
经皮冠状动脉介入治疗后再狭窄率约为30-40%,显著影响经皮冠状动脉介入治疗的临床安全性和有效性。如果没有及时有效的干预措施,血栓形成和再狭窄可能会发展为继发性心肌梗死或中风。药物洗脱支架(DES)已被开发用于在局部血管组织释放抗增殖剂以抑制再狭窄。然而,这些策略不能完全防止内膜增生,也会不加选择地抑制内皮细胞的生长。因此,迫切需要开发治疗经皮冠状动脉介入治疗引起的血管损伤的有效疗法。
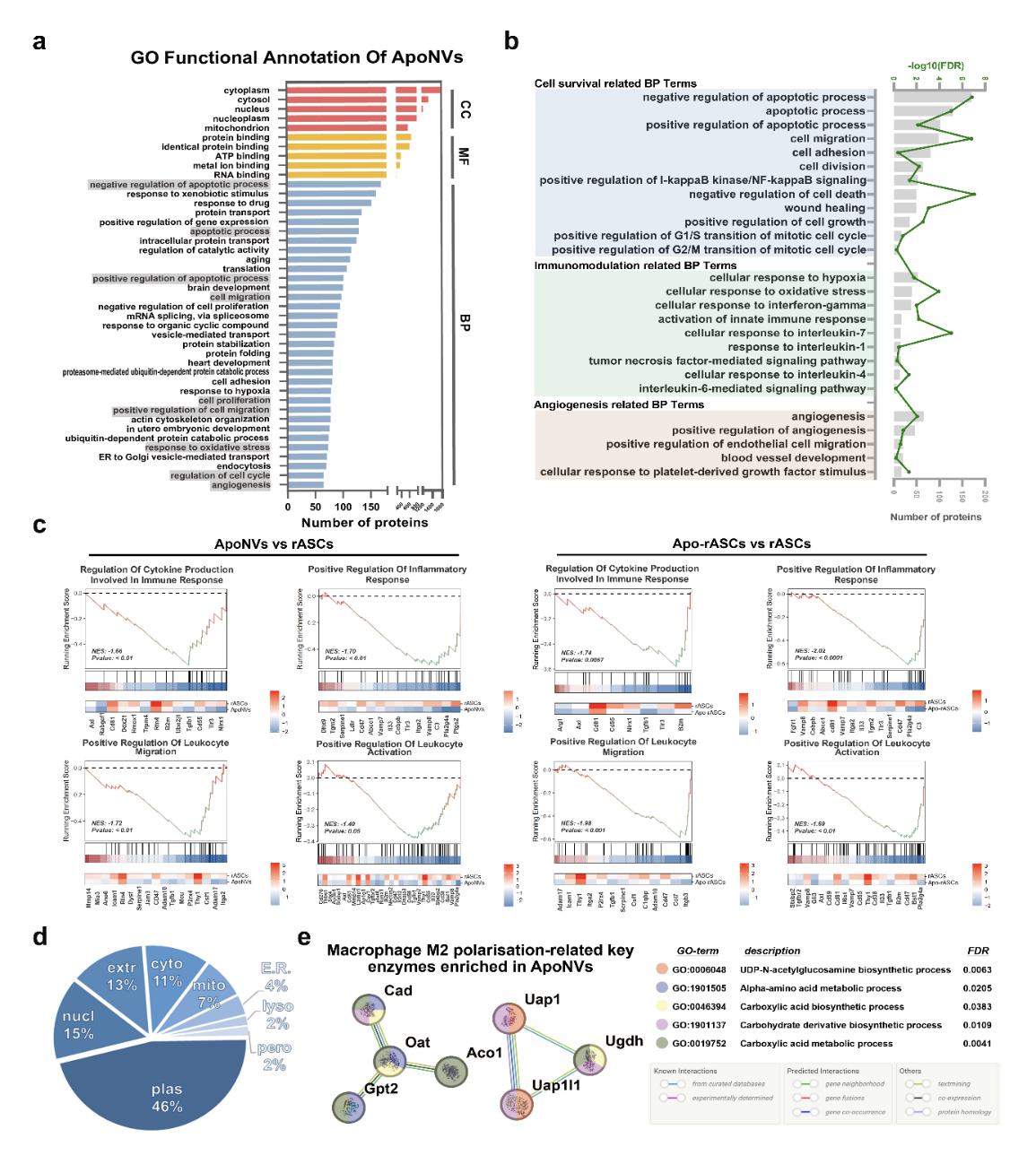
图2. ApoNVs、Apo-rASCs 和 rASCs 的蛋白功能分类和富集分析
血管损伤通常导致内皮剥脱部位血小板的粘附和活化,以及内皮气压伤部位内皮细胞的活化。激活后几分钟内,储存在内皮细胞Weibel-Palade小体内或血小板α颗粒中的P-选择素转移到质膜外表面。P-选择素的外化与其他因素一起可促进血栓形成。此外,活化的内皮细胞释放趋化因子和细胞因子,加速炎性细胞(包括巨噬细胞)的募集。巨噬细胞粘附在受损的血管系统上并释放炎症因子,如活性氧(ROS)、肿瘤坏死因子α(TNF-α)、白细胞介素(IL)-1β和IL-6等,进一步加剧血管炎症损伤。此外,这种强烈的炎症反应会刺激血管平滑肌细胞(VSMCs)转变为增殖表型,从而增加内膜增生的发生率。
为解决上述问题,该团队通过挤出技术直接从凋亡的大鼠脂肪间充质干细胞(rASCs)中制备了凋亡体仿生纳米囊泡(ApoNVs),并研究了它们在修复血管损伤中的作用。这些凋亡细胞来源的纳米囊泡被认为具有优异的免疫抑制特性。此外,我们通过提升产量,以及精确的尺寸控制,以促进体内循环的延长。ApoNVs的表面进一步用P-选择素结合肽(PBP)进行了工程改造,该肽可以有效地结合活化的内皮细胞和血小板,在血管损伤部位进行靶向富集。评估了ApoNVs调节血管损伤关键因素(包括巨噬细胞、内皮细胞和血管平滑肌细胞)的能力。评估了ApoNVs-PBP对活化内皮细胞的靶向能力和调节作用。此外,使用SD大鼠股动脉血管损伤模型进行了体内研究,以探究ApoNVs-PBP对受损血管的影响。
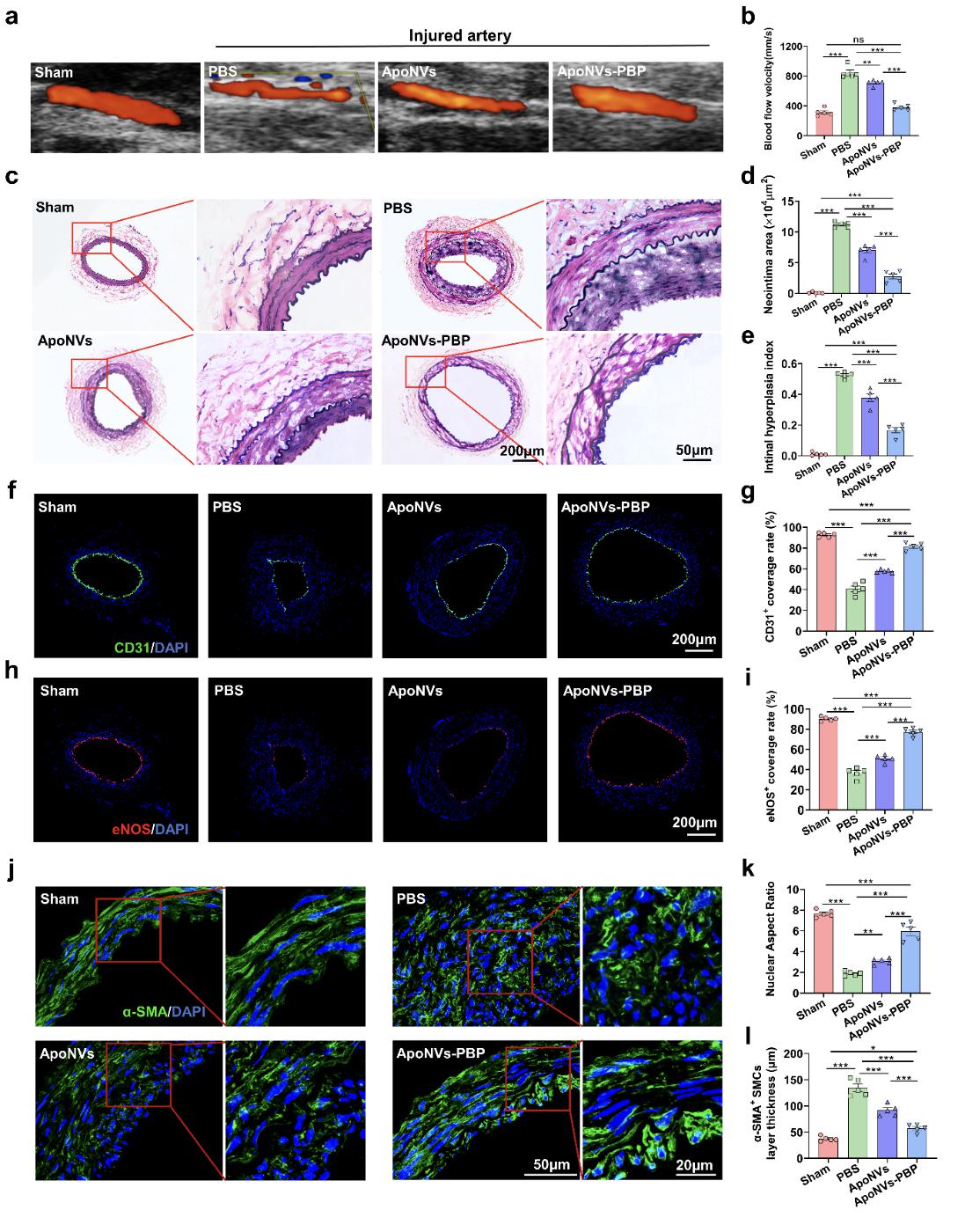
图3. 评估 ApoNVs-PBP 注射对动脉损伤的修复效果
蛋白质组学分析揭示了ApoNVs在免疫调节和血管生成中的潜力(图2)。体外实验结果表明,ApoNVs增强巨噬细胞的M1-M2极化,促进内皮细胞的血管生成功能。尽管ApoNVs处理似乎没有直接影响VSMC的行为,但从ApoNVs处理的巨噬细胞收集的条件培养基抑制了VSMC的增殖和迁移。然后通过疏水插入用PBP进一步修饰ApoNVs,这有助于它们靶向血管损伤部位。随后的体内研究表明,ApoNVs-PBP有效地靶向了金属丝介导的股动脉损伤部位,通过增强巨噬细胞的M2表型来抑制炎症反应。在损伤后21天,与未修饰的ApoNVs相比,ApoNVs PBP显著改善了再内皮化,保持了VSMCs的周向排列,并减轻了受损血管的新生内膜增生(图3)。该研究建立了一种使用靶向递送ApoNVs治疗血管损伤的新方法,并拓宽了基于凋亡细胞策略的治疗应用。(图文/付晓玲课题组)
