华南理工大学纳米医学和生物材料团队在Advanced Materials杂志上发表最新研究成果
2024年5月8日,国际学术期刊Advanced Materials在线发表了纳米医学和生物材料团队以“A Synergistic Chemoimmunotherapy System Leveraging PD-L1 Blocking and Bioorthogonal Prodrug Activation”为题的论文。华南理工大学为论文的第一署名单位,王可伟和姜茂麟为论文的共同第一作者,袁友永教授为论文的通讯作者。
目前,通过化学治疗触发免疫原性细胞死亡亡(ICD)激活强大的T淋巴细胞抗肿瘤免疫已成为癌症治疗的一种有前景的方法。化学免疫疗法将两种治疗机制结合起来能够减少药物剂量和提高治疗效果,并预防肿瘤转移和复发。此外,释放的受损相关分子模式(DAMPs)将免疫细胞浸润差和免疫原性低的“冷”免疫肿瘤微环境转化为免疫原性高的“热”微环境,通过程序性细胞死亡亡蛋白1/程序性细胞死亡配体1(PD-1/PD-L1)显著提高免疫检查点阻断的反应效率。然而,化疗药物在体内的非特异性分布会导致严重的副作用,并不能引发肿瘤特异性免疫原性反应,而且肿瘤微环境中的免疫抑制会限制T淋巴细胞的功能。因此,在克服化疗免疫疗法当前的局限性方面,促进肿瘤特异性药物传递和恢复免疫攻击的新策略仍然具有挑战性。
针对上述问题,该研究团队提出了一种抗肿瘤化疗免疫疗法系统,包括生物正交基团四嗪(TZ)修饰的PD-L1抗体(αPD-L1TZ)以及可通过四嗪生物正交活化的阿霉素前药(DOX-VE),用于自增强的抗肿瘤化疗免疫疗法。首先,αPD-L1TZ通过预靶向富集在肿瘤,接着通过四嗪和乙烯基醚的生物正交点击反应在体内原位激活DOX前药。此外,激活的DOX上调了肿瘤细胞表面的PD-L1,进一步促进了αPD-L1TZ的肿瘤聚集并增强了生物正交前药DOX-VE的活化。此外,激活的DOX诱导肿瘤细胞的免疫原性细胞死亡亡,显著提高了αPD-L1在免疫抑制性肿瘤微环境中的响应效率,通过PD-L1阻断和生物正交的体内前药激活协同增强了化疗免疫疗法系统的抗肿瘤效果。因此,该系统显著增强了αPD-L1在肿瘤中的聚集和前药的活化,并诱导了强大的免疫记忆效应,以防止肿瘤复发和转移,提供了一种可行的化疗免疫疗法联合方案。(图文/袁友永教授课题组)
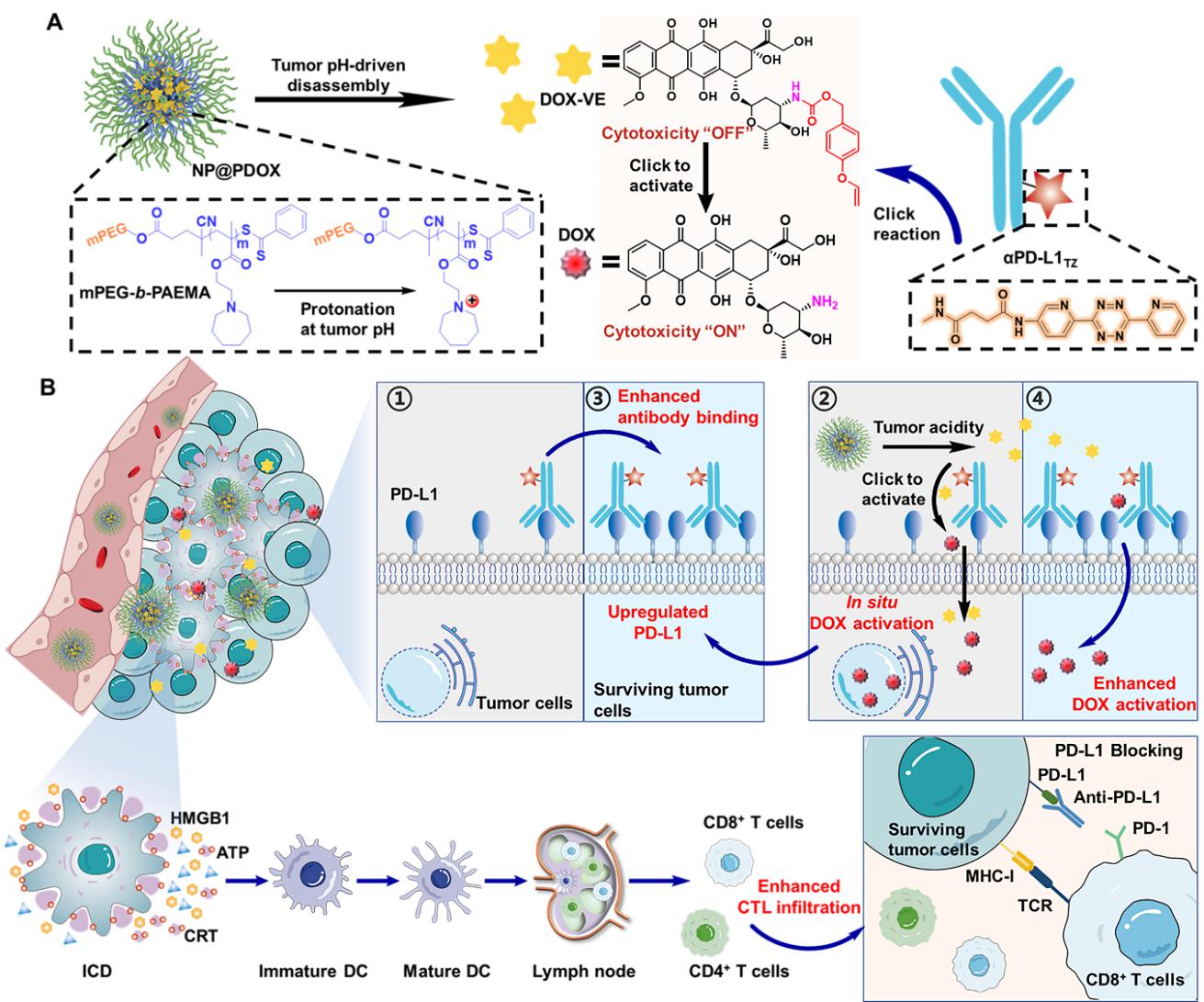
示意图:(A) 生物正交前药DOX-VE和αPD-L1TZ的化学结构及药物释放机制
(B)利用抗体靶向和原位生物正交前药激活相互增强的反馈实现自增强的抗肿瘤化学免疫疗法
附文章链接:https://doi.org/10.1002/adma.202402322
