纳米医学和生物材料团队Advanced Functional Masterials上发表最新研究成果
铁死亡(ferroptosis), 是一种调节性细胞死亡形式,其特征是铁依赖性的脂质过氧化物(LPO)积累,这种不同于凋亡、坏死、自噬的新型细胞死亡方式最近在癌症治疗方面广受关注。特别是,铁离子介导的芬顿反应能够催化内源性H2O2转化为细胞毒性的羟基自由基(·OH),从而导致细胞膜上的LPO过量产生,并触发肿瘤细胞的铁死亡。然而,肿瘤细胞往往需要非常高的Fe剂量才能通过 Fenton反应产生足够的细胞内·OH,这使得以往的铁基纳米递送载体的抗肿瘤效率较低。此外,肿瘤细胞内的谷胱甘肽过氧化物酶4(GPX4)能够通过将细胞毒性的LPO转化为无毒的脂质以维持膜脂双层膜的稳态,从而缓解肿瘤细胞铁死亡。因此,同时上调细胞内的活性氧(ROS)和抑制GPX4活性对基于铁死亡的治疗策略来说是亟待解决的难点。
为了解决以上问题,我们构建了一种由含有功能性二硫键的聚磷酸酯(ssPPE)构成的纳米反应器ssPPELap @Fe-TA,用于增强肿瘤细胞铁死亡。ssPPELap@Fe-TA由基于Fe3+-TA金属多酚网络的壳层和基于ssPPE聚磷酸酯负载β-拉帕醌(H2O2诱导剂)的内核组成。刚性的Fe3+-TA 金属多酚网络壳层能够增强肿瘤细胞的摄取,随后,在溶酶体的酸性环境下,Fe3+-TA 金属多酚网络壳层解离并释放出铁离子,引发 Fe3+ /Fe2+转化驱动的铁死亡。接下来,含有功能性二硫键的聚磷酸酯(ssPPE),通过巯基/二硫键交换反应消耗肿瘤细胞内的谷胱甘肽(GSH),使GPX4失活,并同步触发β-拉帕醌的快速释放,增加细胞内的H2O2和含量,并进一步通过Fe3+介导的Fenton反应增强铁死亡。最终,ssPPELap@Fe-TA通过增加胞内H2O2供应与GSH消耗的协同作用,诱导肿瘤细胞铁死亡,从而有效抑制肿瘤生长。此外,肿瘤细胞铁死亡释放出多种损伤相关分子模式,从而促进树突状细胞 (DC) 成熟和T细胞的肿瘤浸润,并与抗a-PD-L1抗体治疗结合,显著抑制了4T1肿瘤模型的生长和转移。
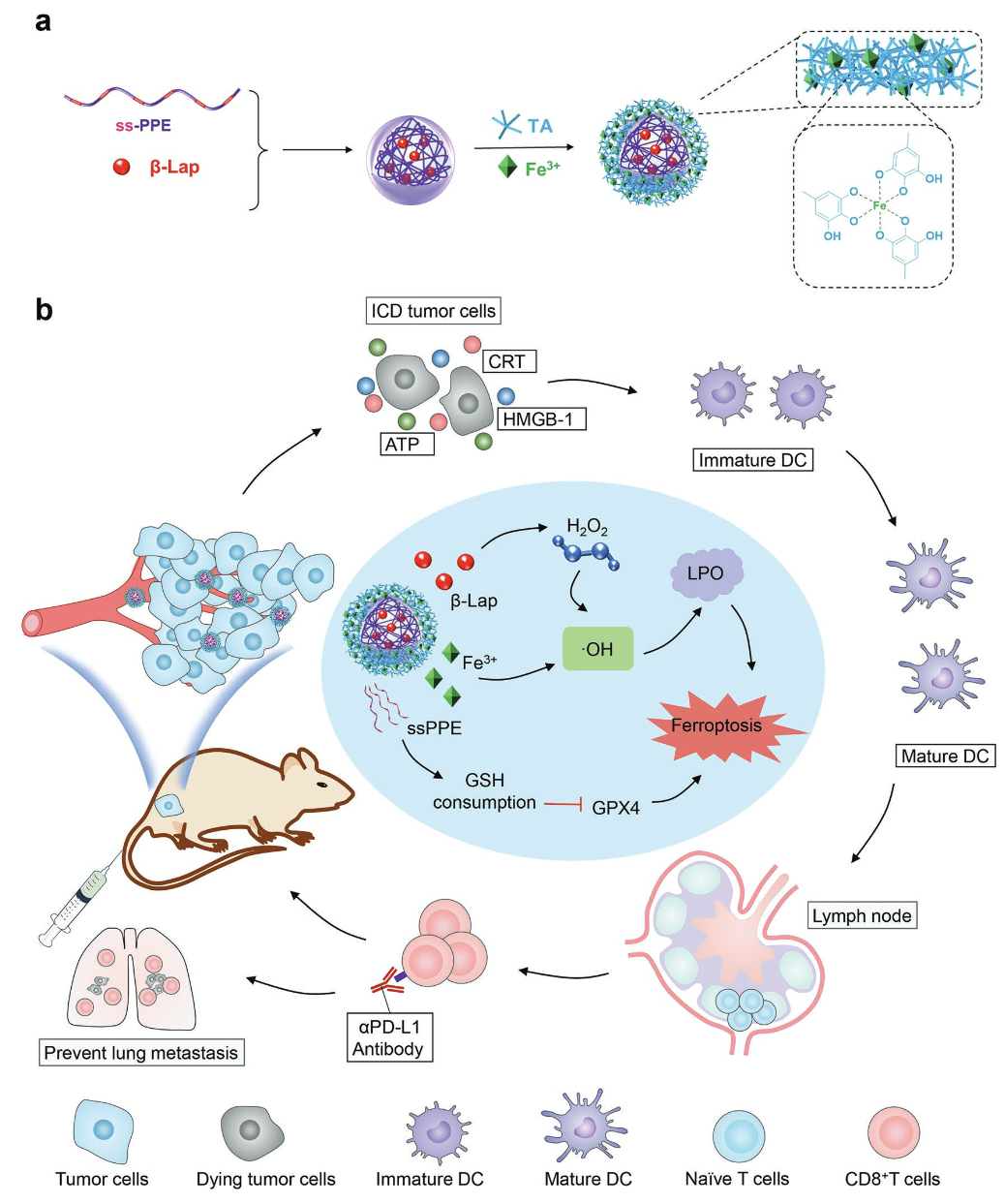
ssPPE Lap @Fe-TA制备过程及其增强铁死亡协同免疫治疗抑制肿瘤生长与转移。
研究成果以“Rigid Shell Decorated Nanodevice with Fe/H2O2 Supply and Glutathione Depletion Capabilities for Potentiated Ferroptosis and Synergized Immunotherapy”为题发表在国际权威学术期刊Advanced Functional Materials上。代旭,朱跃强为论文的共同第一作者,杨显珠教授为论文的通讯作者。
全文链接:https://onlinelibrary.wiley.com/doi/10.1002/adfm.202215022
