科研动态
- 孔宪教授课题组本科生独立工作发表在Mol. Syst. Des. Eng.:电荷监督的等变架构实现数据高效的分子性质预测 02-04
- 华南理工大学孔宪教授团队 《Small》:不对称表面电荷修饰调控受限聚合物电解质中的溶剂化结构和离子电导率 01-28
- 华南理工王宇团队JACS: AI赋能确立“催组装三要素”新原理,开辟手性材料智能创制新范式 12-25
- 华南理工王辉副教授 Nature Communications :靶向线粒体的自发光氟化高分子纳米粒动脉粥样硬化治疗! 11-10
- 华南理工孔宪教授 AFM:PEO基聚合物电解质中氟化模式对溶剂化和离子传输性质的调控 11-10
- 华南理工科研人员合作成果,在Nature发表! 11-03

阿尔茨海默病(AD)是一种逐渐进展的神经退行性疾病,与大脑中的异常蛋白质沉积(特别是β-淀粉样蛋白,简称Aβ斑块)以及金属离子(如铜、锌等)的失衡有着密切的关联。这些异常变化导致大脑神经元功能受损,进而引发记忆力减退、认知功能下降、行为异常等一系列症状。目前,阿尔茨海默病的治疗难度较大,主要依靠药物、非药物治疗及生活方式调整等综合手段来缓解症状、延缓病情进展。然而,由于早期诊断困难、社会认知不足以及治疗方法有限等因素,该疾病的治疗现状仍然面临诸多挑战。
针对AD治疗中存在的挑战,特别是与大脑中异常蛋白质沉积(Aβ斑块)及金属离子失衡相关的问题,华南理工大学王辉课 题组与华东师范大学程义云教授团队创新性地开发了一种基于8-羟基喹啉(8-HQ)的聚合物DHQ。该聚合物旨在通过递送一种关键的抗氧化酶——超氧化物歧化酶(SOD),来有效对抗Aβ聚集介导的神经毒性,从而减缓AD的病情进展。DHQ展现出了卓越的蛋白质递送能力,它能够高效地将SOD精准地递送到目标细胞内。作为出色的蛋白质递送载体,DHQ在递送过程中不仅确保了货物蛋白的稳定性和完整性,还避免了对其生物功能的任何损伤。实验结果表明,当DHQ成功将SOD递送入细胞后,细胞内的活性氧(ROS)水平显著降低,这有助于减轻氧化应激,保护神经元细胞免受Aβ聚集介导的损害。
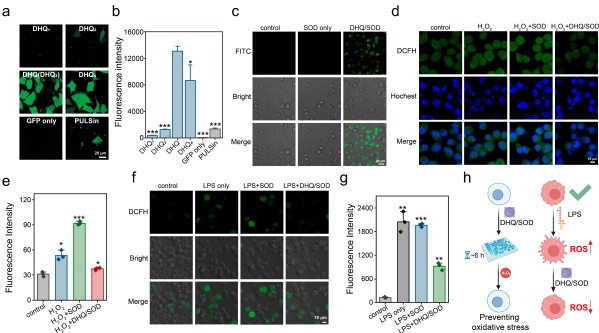
图1. DHQ对蛋白GFP以及抗氧化酶SOD的胞内递送。
此外,该聚合物在纳摩尔浓度下能有效抑制三种与纤维化相关的蛋白质的纤维化:β-乳球蛋白(BLG)、胰岛素和Aβ1-40。其中着重研究了DHQ对Aβ1-40肽纤维化的影响(图2)。结果表明金属离子加速了纤维化过程,但无论金属离子是否存在,DHQ都阻止了Aβ的纤维化进程,保持了Aβ的球形形态。进一步地,DHQ在浓度低至40 nM时即可有效抑制胰岛素纤维化。圆二色性(CD)分析表明,在高温孵育后,胰岛素的二级结构被破坏并变性,而在相同条件下,加入DHQ后胰岛素的二级结构得以保持。这些结果共同表明,DHQ可以有效抑制蛋白质的纤维化过程。
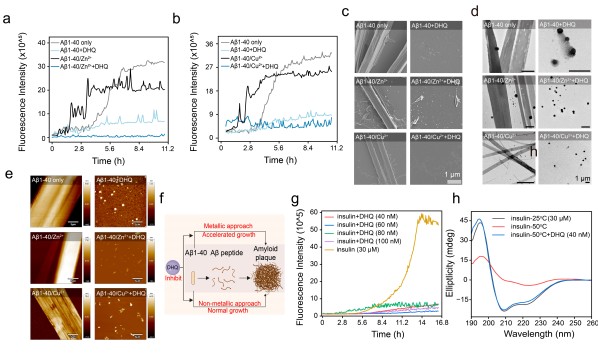
图2.DHQ 对 Aβ1-40 和胰岛素淀粉样变性的抑制作用。
PC12细胞可分化为神经元样细胞,且对各种神经毒性物质敏感且易受损,便于研究阿尔茨海默病(AD)的病理过程。我们将5%RBITC标记与非标记Aβ1-40混合制备可视化纤维聚集体,可从图3看出,DHQ组中未出现明显红色纤维聚集体。Aβ沉积可触发细胞产生ROS,损害细胞正常生理功能并诱导凋亡。图3表明,Aβ1-40增加了PC12细胞内ROS水平,而DHQ或SOD处理均能降低ROS水平,且DHQ/SOD复合物效率最高,其ROS水平与正常生长细胞组相当。
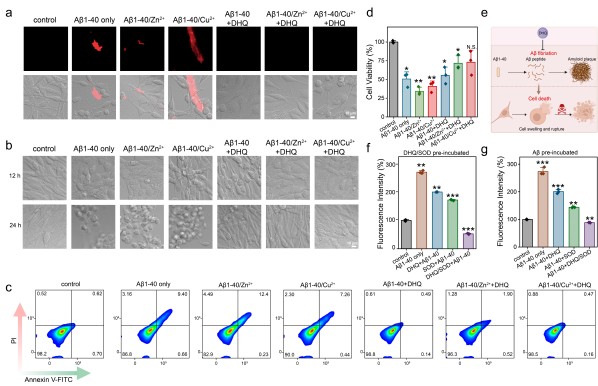
图3.DHQ/SOD 对 PC12 细胞 Aβ 淀粉样变性抑制作用的体外研究。
鉴于Aβ、ROS和细胞毒性关系密切,DHQ递送SOD有望协同增强淀粉样相关疾病的治疗效果,为治疗与淀粉样变性相关的疾病提供了一种多方面的策略。
以上成果近期以“A Hydroxyquinoline Polymer with Excellent AmyloidosisInhibition and Protein Delivery Ability to Combat Amyloid-β-MediatedNeurotoxicity”为题发表在《Nano Letters》上。文章第一作者为华南理工大学前沿软物质学院博士生陈乐,通讯作者为华南理工大学王辉副教授以及华东师范大学程义云教授。
文章信息:
Chen, L.; Hu, Y.;Cheng, Y.; Wang, H. A Hydroxyquinoline Polymer with Excellent AmyloidosisInhibition and Protein Delivery Ability to Combat Amyloid-β-MediatedNeurotoxicity. Nano Lett. 2024. https://doi.org/10.1021/acs.nanolett.4c03275.
原文链接:
https://doi.org/10.1021/acs.nanolett.4c03275



