王菊芳教授课题组在Analytical Chemistry发表论文: 一锅法Rlock-CRISPR/Cas12a驱动的RCA循环用于快速、高灵敏检测APE1
近日,华南理工大学生物科学与工程学院王菊芳教授团队在癌症早期诊断技术领域取得重要进展,成功开发了一种名为“Rlock”(RCA-Lock)的通用核酸探针平台及其衍生的超快速高灵敏检测方法——RCRE,可用于关键癌症标志物脱嘌呤/脱嘧啶核酸内切酶1(Apurinic/apyrimidinic endonuclease 1,APE1)的快速检测。相关成果发表在国际分析化学主流期刊Analytical Chemistry,论文题目为 “One-Pot Rlock-Mediated CRISPR/Cas12a-Driven RCA Cycle for Rapid and High-Sensitive APE1 Detection”。 2023级硕士研究生山君卓为第一作者,王菊芳教授为通讯作者,华南理工大学为第一完成单位。(论文链接:https://doi.org/10.1021/acs.analchem.5c03234)
APE1是DNA损伤修复的关键酶,在多种肿瘤细胞中异常高表达,是极具潜力的癌症早期诊断标志物。然而,现有的APE1检测方法常面临操作复杂、耗时长、灵敏度不足或设备昂贵等挑战,限制了其在即时检测(Point-of-Care Testing,POCT)中的应用。滚环扩增技术(Rolling Circle Amplification,RCA)虽灵敏度高、操作简便,但难以直接用于APE1的特异性、便捷检测。
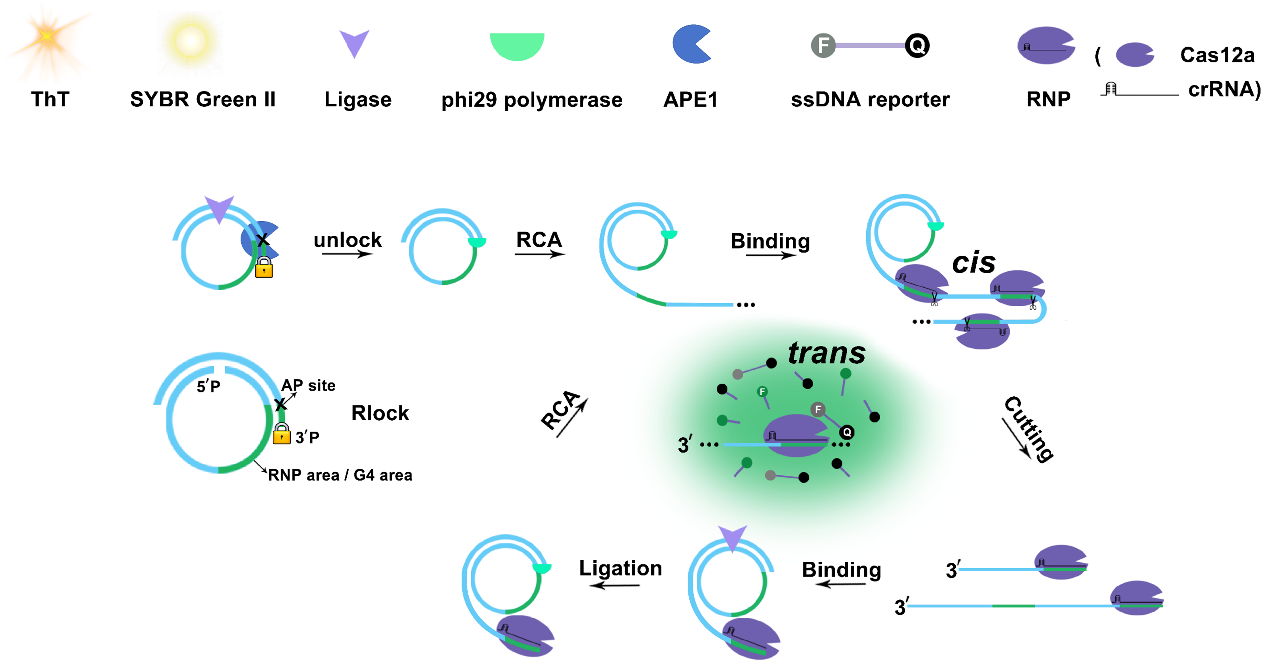
图1 Rlock的结构以及RCRE的工作原理
王菊芳教授团队首次设计了一种名为“Rlock”的核酸探针。该探针由一个带有AP位点(APE1的作用靶点)和3'端磷酸化封闭基团(pho)的引物,与一个5'端磷酸化的挂锁探针构成稳定的双链结构组成。其创新性在于充当“通用转换器”:当APE1存在时,能特异性识别切割Rlock中的AP位点,暴露出3'羟基作为引发端,直接启动后续的RCA扩增。这一设计巧妙绕过了传统的APE1检测中预先裂解发夹状探针的复杂步骤,将操作简化为单步、单管的37°C等温反应,为简便APE1检测奠定了基础。
基于Rlock平台,团队开发了“Rlock介导的CRISPR/Cas12a驱动的RCA循环”(RCRE)检测方法,首次将CRISPR/Cas12a系统结合RCA技术并应用于APE1检测。其作用机制如下:(1)APE1切割Rlock并暴露3'羟基;(2)触发的RCA产生含Cas12a识别位点的长单链DNA;(3)Cas12a-crRNA复合物结合并“顺式切割”RCA产物,产生的片段成为新一轮RCA引物,形成自我维持的扩增循环;(4)持续激活的Cas12a发挥“反式切割”活性,剪切荧光标记报告分子,产生强荧光信号,实现超高灵敏检测。
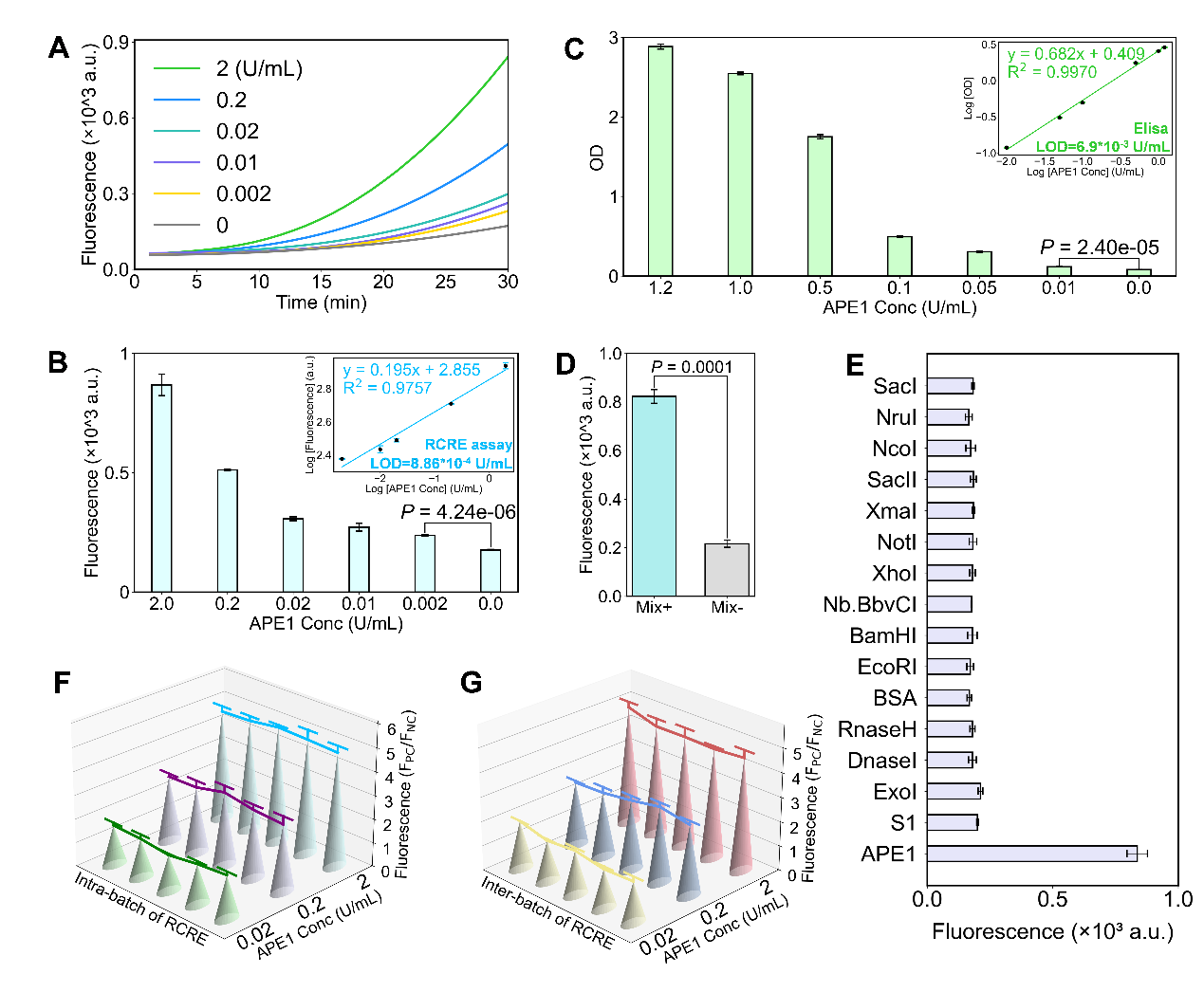
图2 RCRE的检测性能 (A) 不同APE1浓度触发30分钟RCRE的实时荧光曲线。(B) RCRE检测:对数转换荧光强度与对数转换APE1浓度的线性回归;计算得出检测限为8.86×10⁻⁴ U/mL。(C) ELISA检测:对数转换OD值与对数转换APE1浓度的线性回归;计算得出检测限为6.9×10⁻3 U/mL。(D) 使用RCRE检测混合样本中的APE1。(E) RCRE对APE1与其它非相关核酸酶的特异性测试。不同APE1浓度下的(F)批内稳定性与重复性分析及(G)批间稳定性与重复性分析。
RCRE方法展现出卓越性能:检测限低至8.86×10⁻⁴ U/mL,30分钟内即可完成检测,操作简便(单管反应,37°C恒温),且具有优异特异性。Rlock平台具有高度通用性,可将多种基于RCA的检测便捷转化为APE1响应型检测。作为基于Rlock平台开发的杰出方法,RCRE为癌症早期、快速、便捷诊断提供了强大新工具,并在POCT和生物医学研究领域展现出广阔的应用前景。
该工作得到了广州市科技计划项目(2024B01J1277)的资助。