朱伟教授在ACS Nano发表论文:“点石成骨”—界面硅化介导无需外源性骨诱导因子实现高效成骨分化
近日,华南理工大学生物科学与工程学院朱伟教授课题组,在国际知名期刊《ACS Nano》(IF=18.3)上在线发表题为:“Interfacial Silicification Efficiently Drives Osteogenic Differentiation of Mesenchymal Stem Cells without Any Exogenous Osteoinductive Factor”的研究论文,提出了一种无需外源性骨诱导因子即可实现间充质干细胞(MSCs)高效成骨分化的全新策略。华南理工大学生物科学与工程学院硕士研究生田周萍为第一作者,朱伟教授和陈洪林副教授为通讯作者,华南理工大学为第一通讯单位。
论文链接:https://pubs.acs.org/doi/full/10.1021/acsnano.5c01628
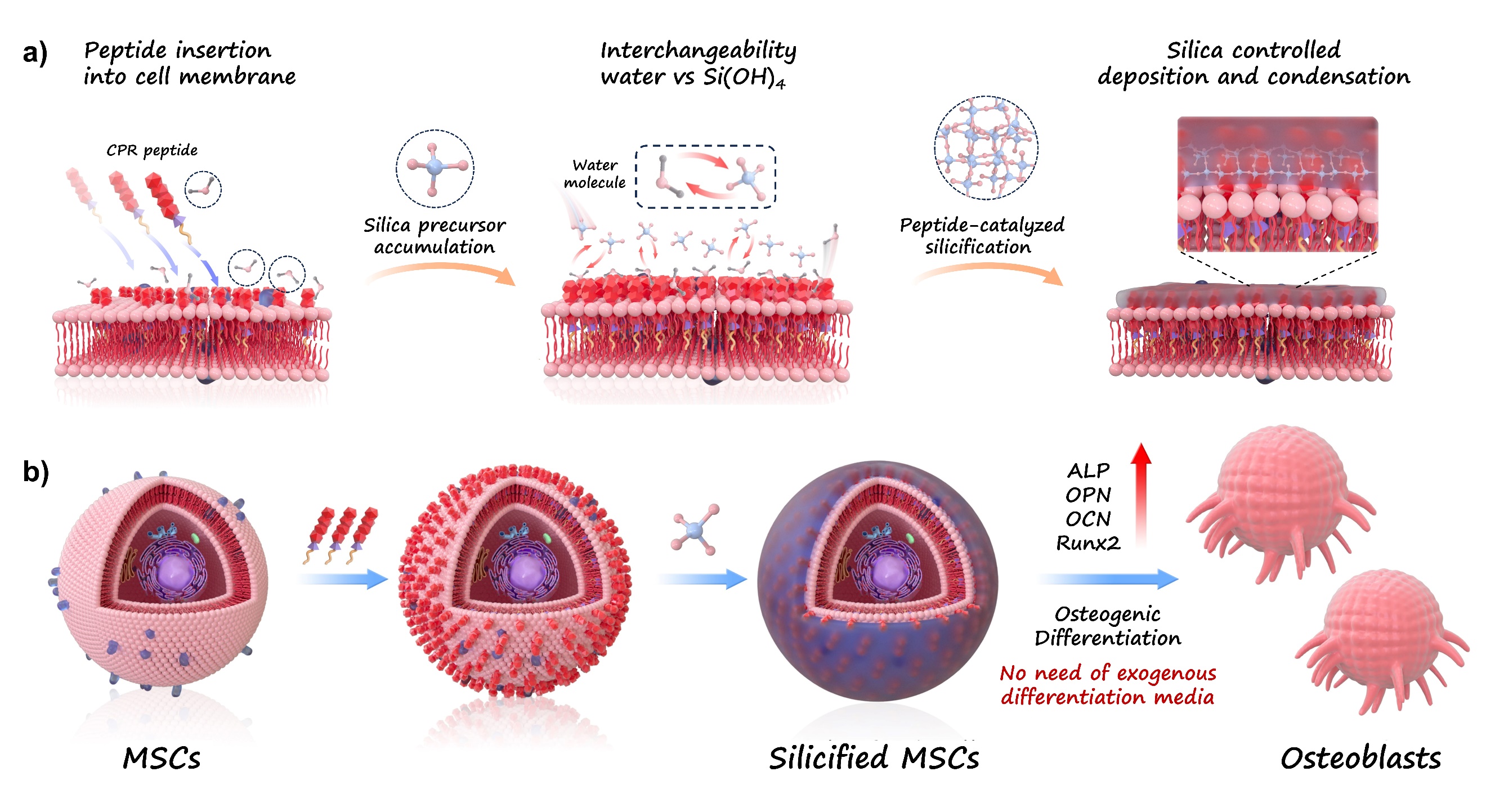
图1. 基于多肽驱动界面硅化的MSC成骨分化策略示意图。a) CPR多肽嵌入细胞膜后引导硅源前驱体在细胞膜聚集,水解,进入实现局部硅化沉积;b)MSC在无需外源性骨诱导因子的条件下,经硅化处理后诱导表达ALP、OPN、OCN、RUNX2等标志物,完成向成骨细胞分化。
间充质干细胞(Mesenchymal Stem Cells, MSCs)具备自我更新和多向分化潜能,是组织工程与再生医学的重要种子细胞。其中,成骨分化是其最典型和重要的应用方向。传统诱导策略多依赖外源性成骨诱导因子(如BMP-2、DEX等)或特定培养基,尽管具有良好效果,但操作复杂、成本高、临床转化性受限,且存在细胞毒性与不可控性等问题。如何在无外源条件下高效驱动MSCs成骨分化,是当前干细胞治疗与组织工程的重大挑战。
为突破这一瓶颈,研究团队创新性地提出了一种无需外源性骨诱导因子的MSC定向诱导新策略——界面硅化(interfacial silicification)技术。该方法基于设计合成的两亲性多肽CPR(C16K(PEG)6RRIL),通过分子界面工程在MSC细胞膜表面实现原位硅化反应,从而激活内源成骨程序。
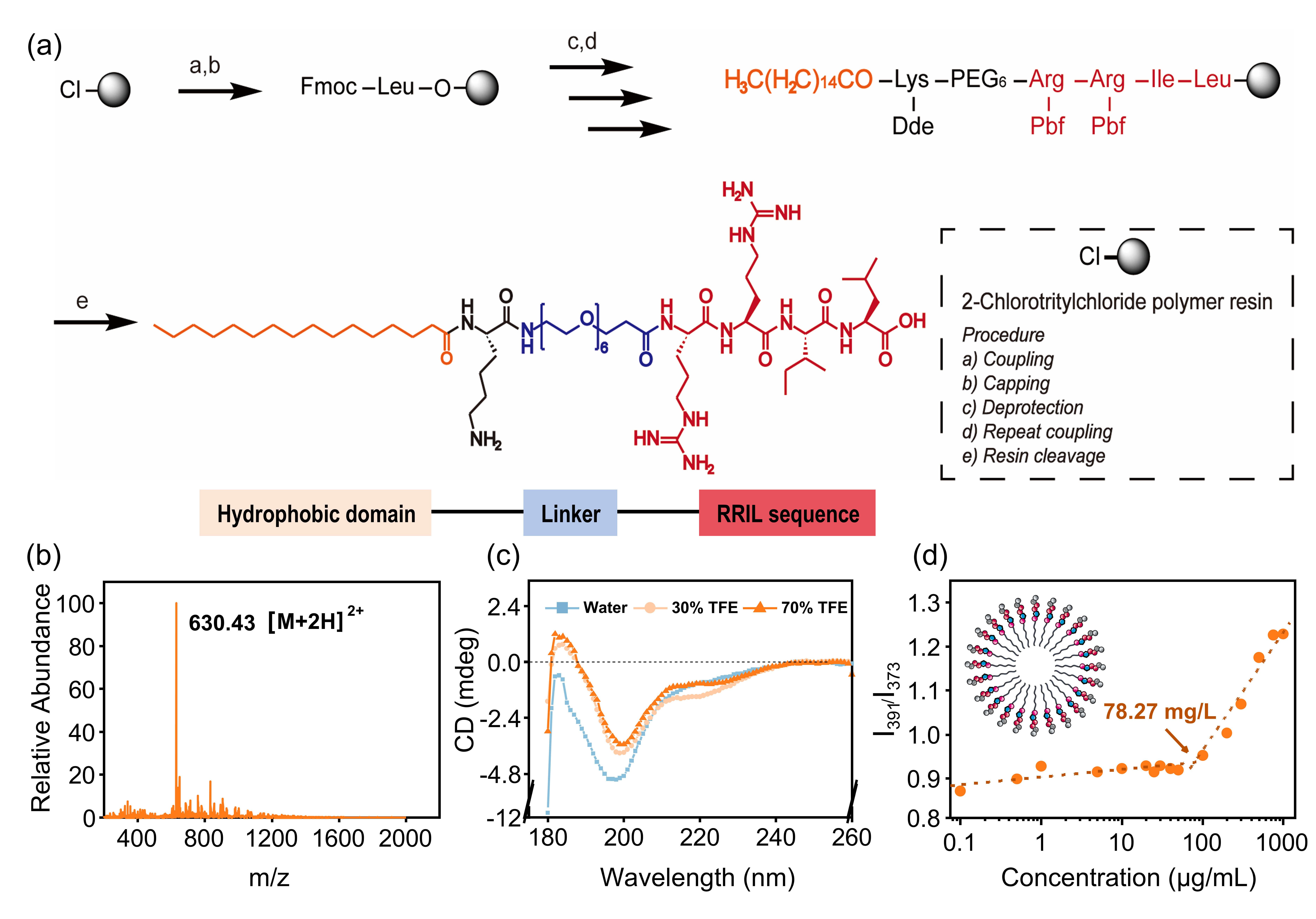
图2. CPR功能肽的合成与结构表征。
具体而言,CPR多肽由三部分构成:疏水端(棕榈酸)锚定细胞膜,亲水段(PEG)提升生物相容性,功能段(RRIL)引导硅前体聚集并催化硅化反应。该多肽可在不改变细胞活性的前提下,在细胞表面形成一层致密的硅化壳层。这一“分子层面定向沉积”的过程不仅改变了MSCs的胞外基质微环境,还显著上调了多种成骨相关因子如RUNX2、OCN与OPN的表达。通过qPCR、免疫荧光与钙化检测等手段验证,该方法在小鼠与人源MSC中均实现了与传统成骨培养基相当甚至更优的成骨诱导效果。
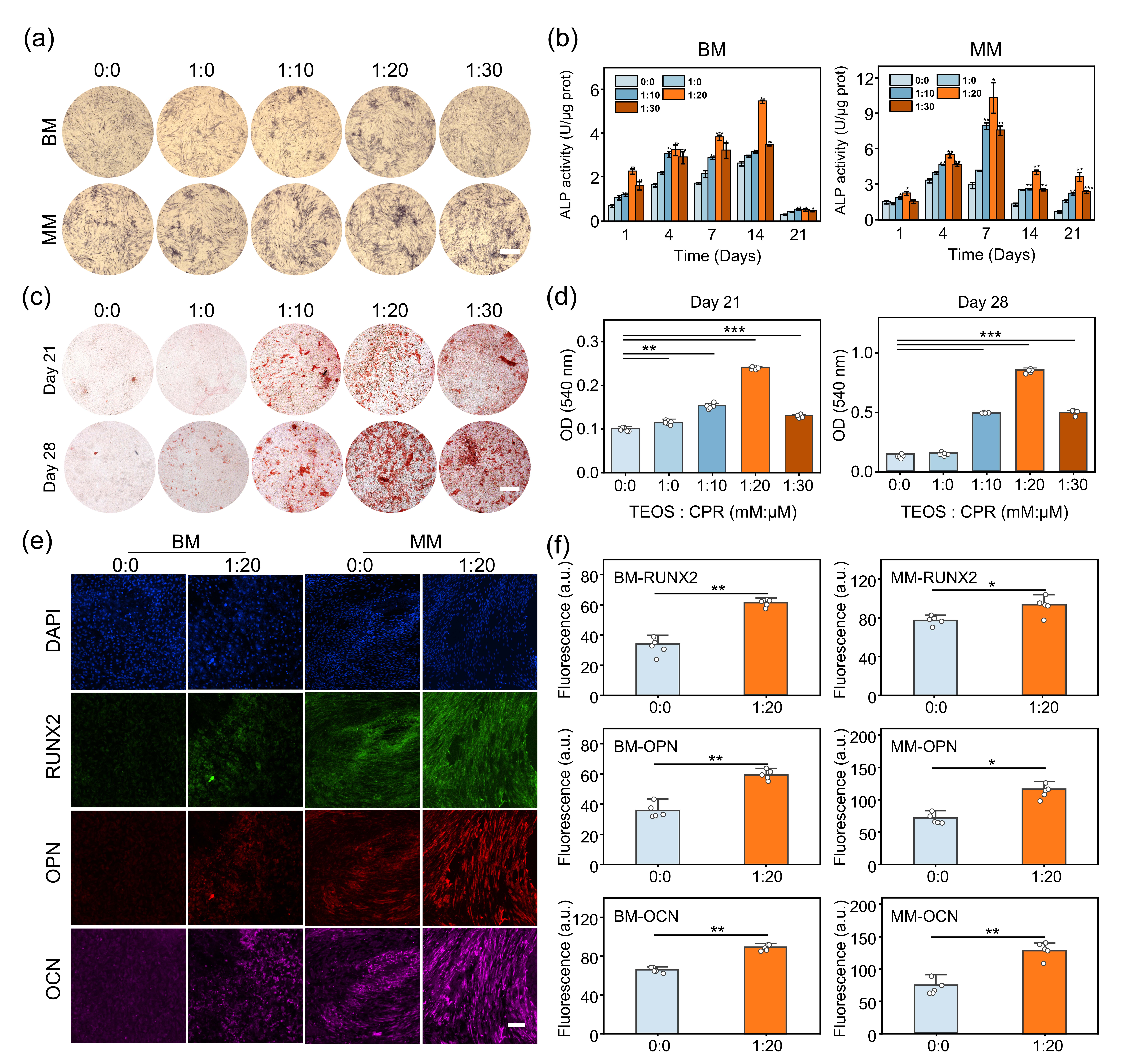
图3. 界面硅化显著促进SDMSC成骨分化。
实验结果显示,经过CPR+TEOS处理的MSC在基础培养液中即可展现出显著的成骨表型,包括:(1)ALP活性显著上升,在Day 7和Day 14出现峰值;(2)矿化能力增强,Alizarin Red染色结果显示钙化结节面积大幅提升;(3)成骨关键基因表达显著提高,如RUNX2、OPN、OCN等;(4)RNA-seq分析揭示多通路激活,如Wnt、Hippo、BMP、MAPK、PI3K-Akt等,均为成骨相关信号通路;(5)ECM重塑显著,胶原、基质金属蛋白酶(MMPs)、组织金属蛋白酶抑制因子(TIMPs)等关键分子表达被大幅上调。揭示该策略可激活包括Wnt、MAPK、PI3K-Akt等经典成骨信号通路,并重构细胞黏附、外基质重塑等核心功能。
同时,该策略在多个物种来源的MSC(包括大鼠、成人骨髓和脐带MSC)中均取得一致的效果,证明其具有良好的适用性和普适性。更重要的是,该方法操作简便,无需特殊培养体系,为低成本、高效率的干细胞诱导提供了新思路。
本研究不仅丰富了干细胞工程与再生医学的理论基础,也为构建“外源因子零依赖”的成骨治疗新模式提供了技术支撑。该策略未来有望应用于骨组织工程、成骨支架材料、临床干细胞药物开发等多个前沿领域,推动干细胞定向诱导技术的实际转化。
该研究得到了国家自然科学基金、广东省珠江人才计划、广东省引进创新创业团队计划、广东省重点领域研发计划等项目的支持。