朱伟教授在Cell子刊Cell Biomaterials发表前瞻性论文:体内聚合助力肿瘤免疫治疗
近日,华南理工大学生物科学与工程学院朱伟教授在Cell子刊Cell Biomaterials上在线发表题目为“In situ polymer synthesis within living systems for cancer immunotherapy”的论文,系统阐述了体内原位聚合在肿瘤免疫治疗中的最新研究进展与未来发展方向。华南理工大学生物科学与工程学院博士后陈韵(现在新加坡南洋理工大学从事博士后研究)为第一作者,朱伟教授为通讯作者。
论文链接:
https://www.sciencedirect.com/science/article/abs/pii/S3050562325000625
癌症免疫治疗虽已革新肿瘤治疗格局,但其疗效受限于肿瘤免疫原性低、抗原呈递效率不足、T细胞激活障碍及免疫抑制性肿瘤微环境(TME)等多重挑战。传统治疗策略难以精准调控免疫应答的各个环节,亟需开发能在生物体内动态响应的新型治疗手段。合成聚合物因具备可设计的组成、结构与形态,在药物递送与免疫调节中展现出独特优势,而活体内原位聚合物合成策略有望通过靶向干预免疫调节全流程,突破现有治疗局限。
研究团队提出的原位聚合物合成策略涵盖四大应用场景,通过精准调控免疫微环境与细胞功能,实现治疗效能的全面提升:
细胞内环境调控:利用酪氨酸酶催化氧化聚合生成黑色素,增强光热治疗诱导的免疫原性细胞死亡(ICD);通过谷胱甘肽(GSH)触发的肽段自组装,将线粒体自噬从促生存模式转变为促死亡模式,重塑肿瘤代谢微环境。此外,近红外光触发的铂(IV) 前药原位聚合可抑制顺铂外排,协同化疗与免疫治疗。
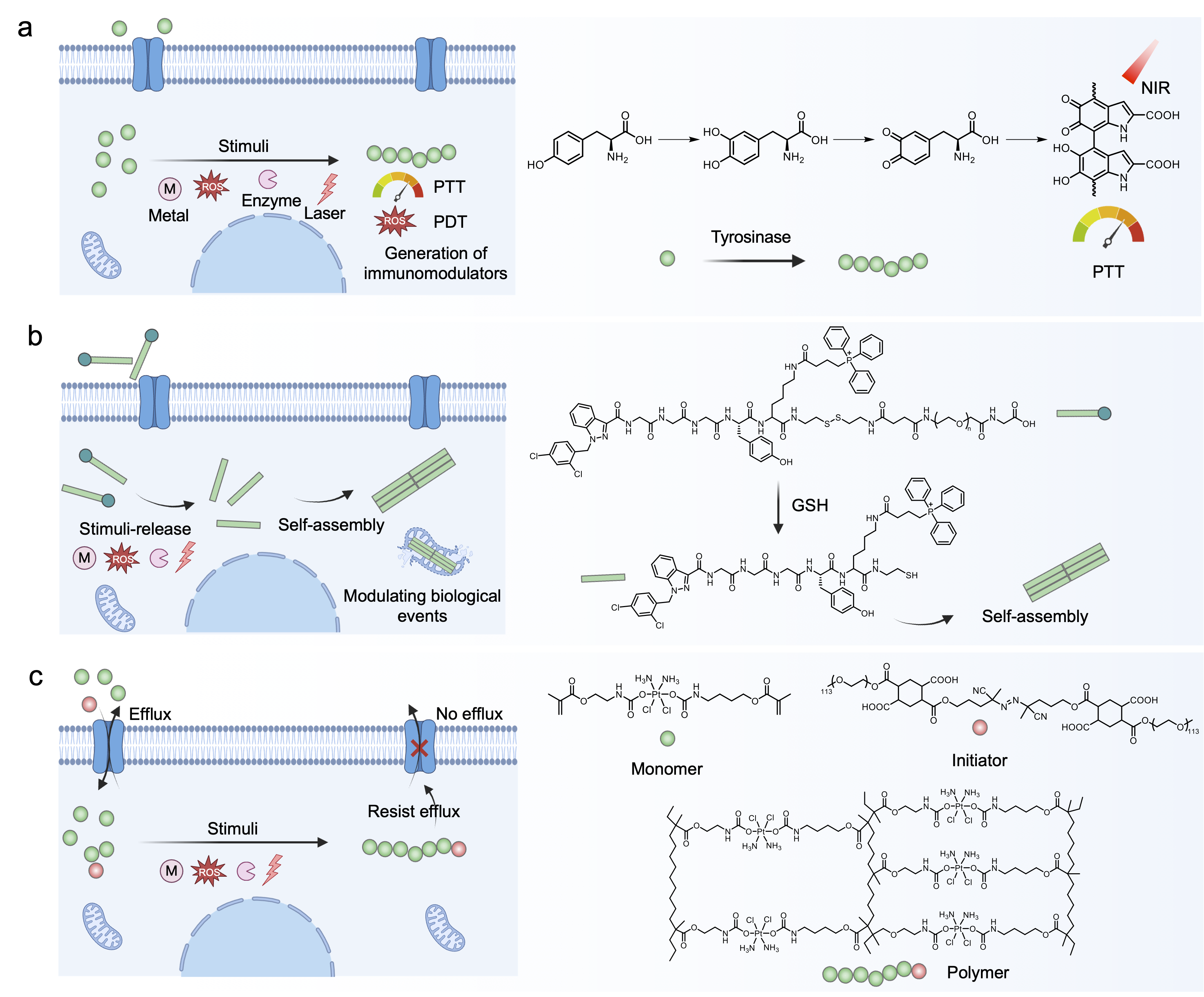
图1. 细胞内聚合反应实现免疫调控
细胞表面工程:通过碱性磷酸酶(ALP)指导的自组装,选择性降解肿瘤细胞表面PD-L1,解除免疫抑制;利用低温硅化技术制备全肿瘤细胞疫苗(WTCVs),保留肿瘤抗原并修饰病原体相关分子模式(PAMPs),增强免疫应答。工程化细菌表面通过多巴胺氧化聚合锚定免疫检查点抑制剂,实现抗肿瘤与抗病毒免疫的双重激活。
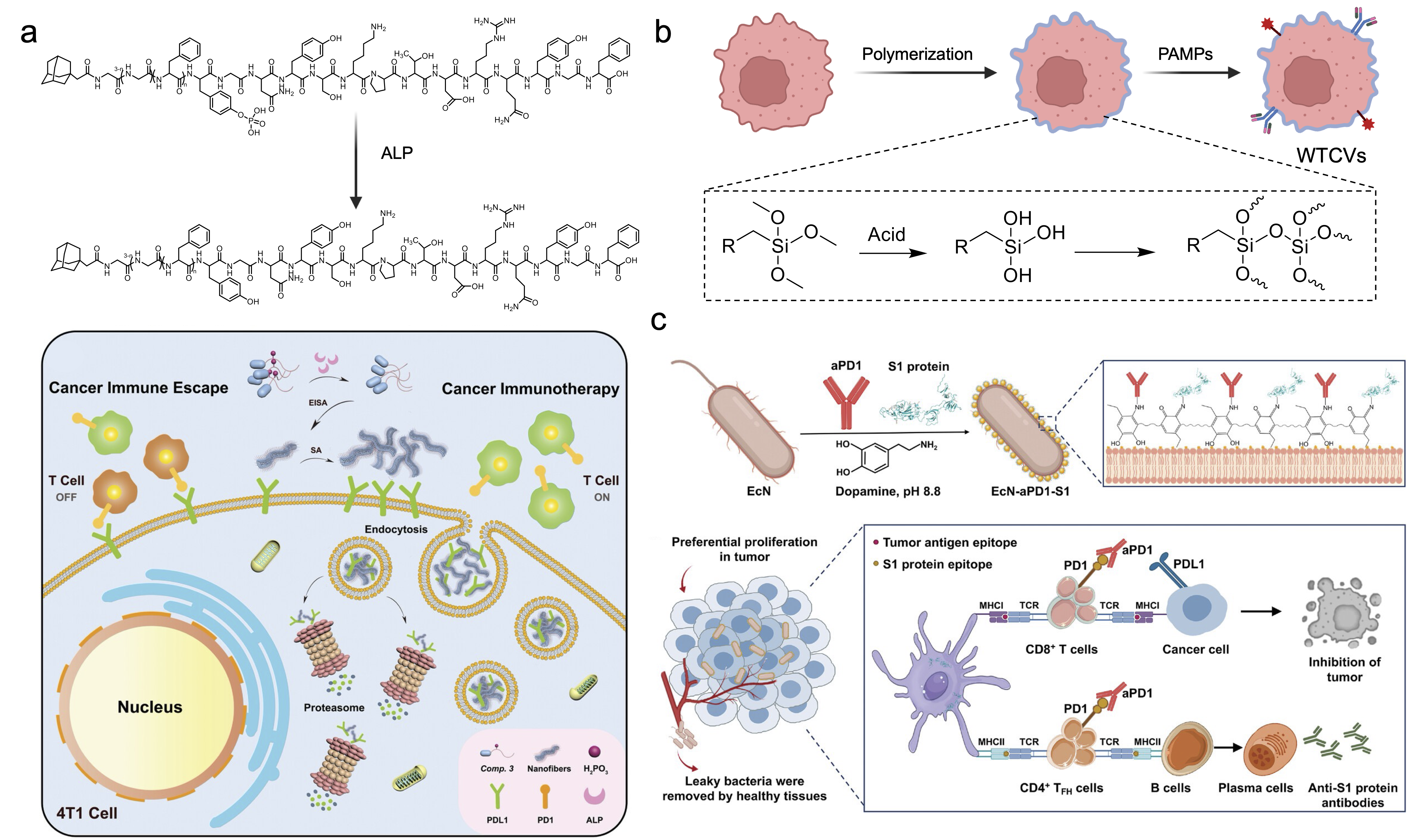
图2. 细胞表面聚合实现免疫调控
肿瘤微环境重塑:基于肿瘤微环境中过氧化氢(H2O2)响应的氧化聚合,生成近红外二区光热剂,诱导ICD并激活免疫循环;光触发的肿瘤内凝胶化系统可保留过氧化氢酶(CAT)与光敏剂,缓解肿瘤缺氧并重复激活免疫应答。微藻整合的活体水凝胶通过光合作用供氧,逆转免疫抑制性TME,增强肿瘤饥饿疗法与免疫治疗的协同效应。
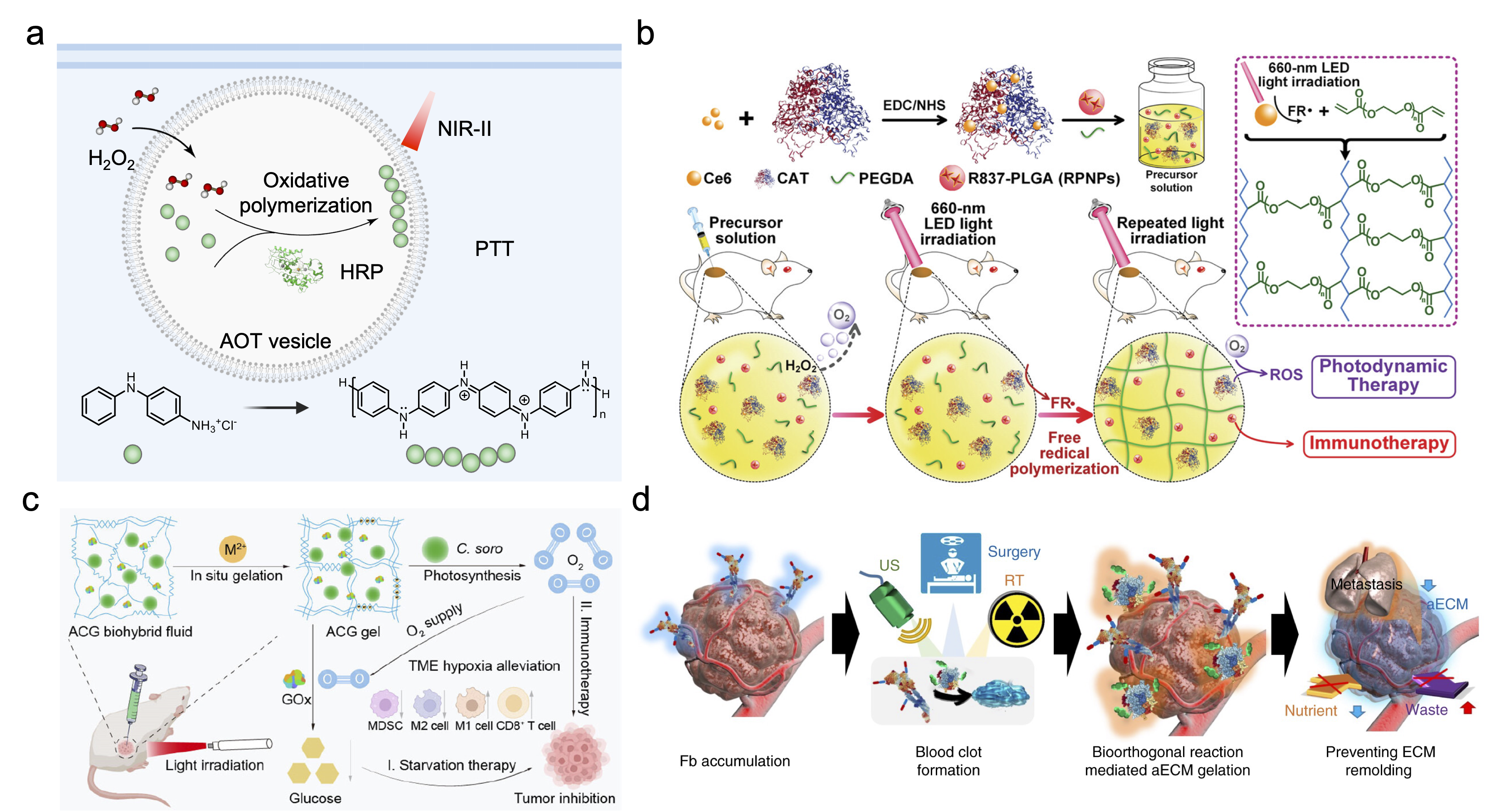
图3. TME中聚合实现免疫调控
皮下组织免疫激活:原位聚合介导的抗原呈递(IPAP)策略可自发形成抗原负载纳米疫苗,锚定树突状细胞(DCs)并促进抗原在引流淋巴结的积累;喷雾式外泌体交联凝胶作为人工淋巴结,直接激活细胞毒性 T 细胞,为术后肿瘤免疫治疗提供新范式。
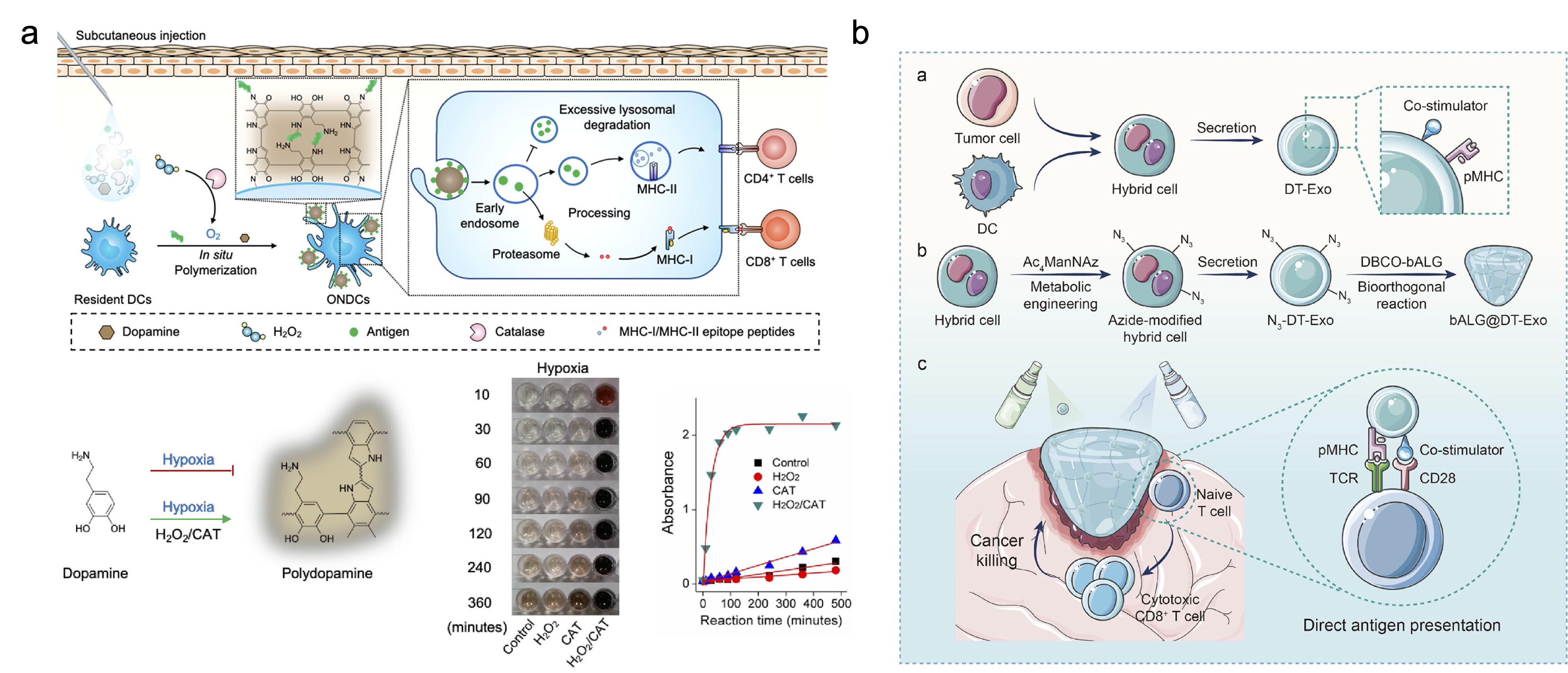
图4. 皮下组织中聚合实现免疫调控
文章提出,这一技术的突破性意义在于将传统材料科学的“体外制备-体内递送”模式,革新为“体内按需合成-功能动态表达”的智能体系。活体内聚合策略不仅突破了传统免疫治疗中药物代谢快、靶向性差的瓶颈,更开创了生物合成与免疫调控的交叉研究范式——通过编程聚合物在细胞内、细胞膜、肿瘤微环境及淋巴组织等不同维度的精准合成,实现了从肿瘤抗原呈递、免疫细胞激活到微环境重塑的全链条干预。
在此领域,朱伟教授课题组开展了大量研究工作(Advanced Materials 2019, 31 (12), 1970082.;ACS Nano 2021, 15 (3), 3900–3926.;Matter2022, 5 (8), 2434–2436.; ACS Nano2022, 16 (9), 13919–13932.;Nat Commun2023, 14 (1), 5229;Chem. Mater.2023, 35 (12), 4731–4742.),构建了活体内原位聚合的方法学体系,通过生物医学与材料科学的交叉创新,实现了肿瘤免疫治疗中从抗原呈递调控、免疫微环境重塑到治疗性分子原位生成的全链条技术突破,为后续临床转化奠定了坚实的理论与技术基础。
该研究得到了国家自然科学基金、广东省珠江人才计划、广东省引进创新创业团队计划等项目的支持。