朱伟教授团队在Angewandte Chemie发表论文: “硅酶”-多组元硅化增强单酶结构实现酶活性-稳定性平衡
近日,华南理工大学生物科学与工程学院朱伟教授课题组在国际著名期刊Angewandte Chemie(IF=16.6)杂志上在线发表题目为“Multivariate Silicification-Assisted Single Enzyme Structure Augmentation for Improved Enzymatic Activity-Stability Trade-Off“的研究论文。华南理工大学生物科学与工程学院博士研究生郑观生为第一作者,华南理工大学为唯一通讯单位。
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202406110
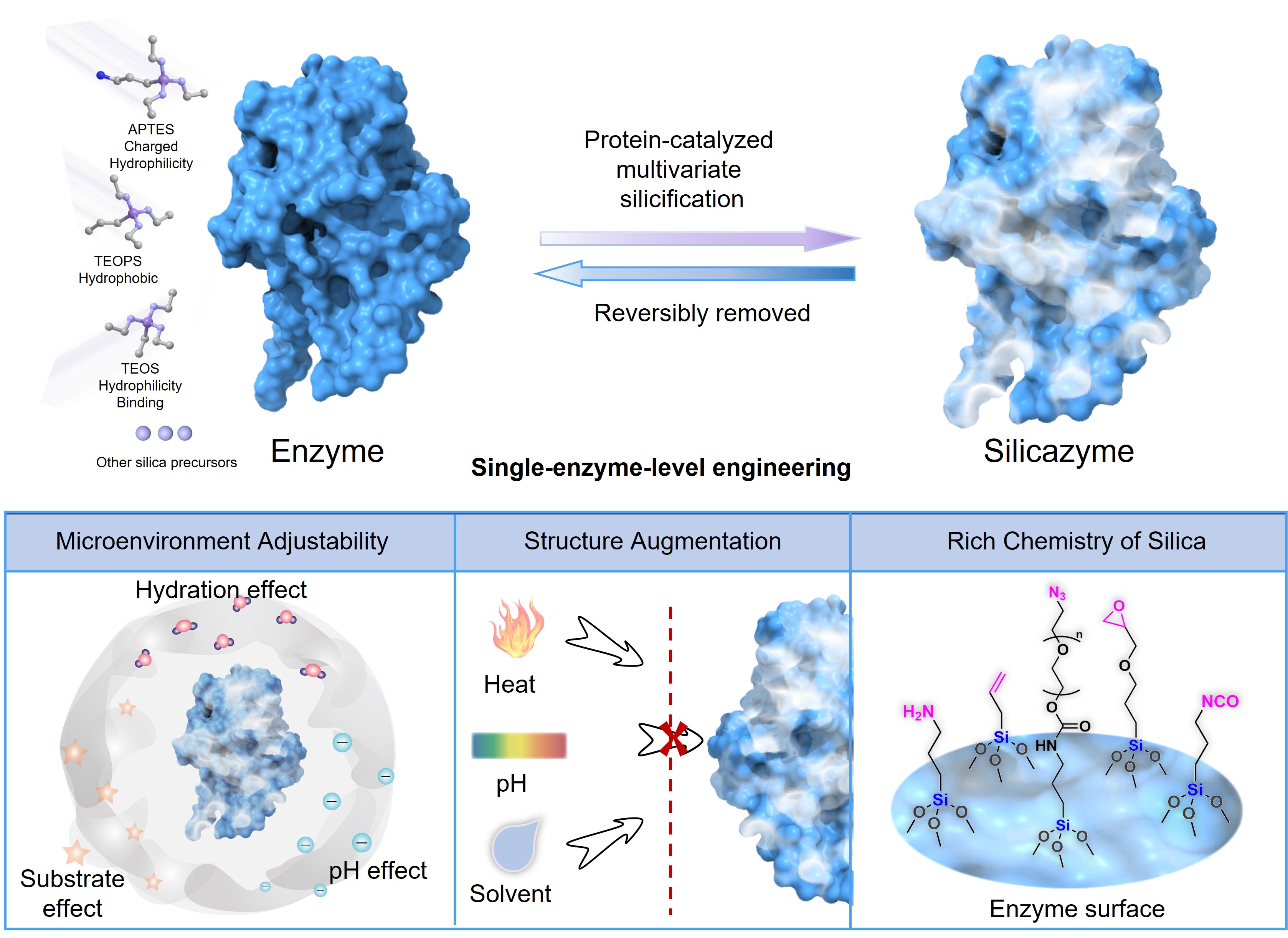
图1. 上图:可逆多组元硅化过程制备硅酶示意图;下图:硅酶优点阐述,包括酶表面微环境可调节,结构增强提升抗性,通过二氧化硅丰富的化学性质实现酶的功能扩展。
酶对生命至关重要,可加速细胞内发生的大量生化反应,承担着催化几乎所有代谢过程的重要任务。酶在温和的条件下具有高催化效率和高底物特异性,能够有效稳定化学反应的过渡状态,从而降低其活化能。凭借这些优异特性,酶作为绿色催化剂,被广泛用于纺织、生物燃料、生命支持、食品行业、制药行业和医疗设备等领域。然而,酶的催化特性在很大程度上取决于它们的三维分子结构和活性位点,任何干扰这种结构的外部因素,如温度或pH值的微小变化,都可能对酶的活性产生有害甚至不可逆的影响。为了提高酶的结构稳定性,进而扩大其应用范围,目前已发展多种手段对酶进行工程化处理,包括改变酶的结构、调节酶周围的微环境或者酶固定化。然而,这些策略在单酶尺度下的调控难以同时满足以下要求:(1)保持高酶活性;(2)增强对温度变化、有机溶剂、脱水和/或极端pH的长期抵抗能力;(3)能够调节或可逆改变酶活性。酶高质量改造的关键挑战在于如何发展新的策略在单酶尺度实现其构象的柔性和刚性之间的平衡。
硅基基质具有化学惰性、机械强度高和热稳定性好等优良特性而被广泛用于酶固定化。以硅基基质调控生命体活动,解决生物样本冷链,朱伟教授课题组开展了大量工作(Nat. Rev. Bioeng. 2024, 2, 282; ACS Nano2022, 16, 2164;Nat. Commun. 2022,13, 6265;J. Am. Chem. Soc. 2021, 143, 17, 6305等)。然而,在单酶尺度下,由于酶表面的化学多样性和异质性,精确调控酶与硅基基质的相互作用非常困难且鲜有报导。
在此工作中,朱伟教授课题组提出一种新的杂化酶概念 — 硅酶 (silicazyme),其核心在于将具有不同化学性质的硅基前驱体与酶复合,进而在单酶尺度实现结构稳定性-酶活性的精确调控,实现单酶尺度下酶结构强化、活性调控、稳定性提升和功能扩展。硅酶具有几大优势:1)酶活性调节能力——多组元硅化衍生的化学多样性改变了二氧化硅框架与酶之间的相互作用,从而有效调控酶表面微环境,实现酶活性调节;2)酶结构强化——引入的无机框架不仅可以调控酶的柔性/刚性,提升结构稳定新,还大大增强了酶对外界变化(如温度、还原剂/氧化剂、溶剂和pH)的抵抗能力;3)可逆性——硅基介质与酶的复合可通过低浓度的HF-NH4F缓冲溶液快速去除,同时不影响原有酶的生物活性和结构;4)功能可扩展性——二氧化硅框架具有丰富的化学性质,硅酶可通过硅端对酶化学性质和功能调控而不影响已有酶结构。
硅酶,作为一种新型的杂化酶,由于其同时实现了酶活性-结构稳定性的平衡,其必将在一系列不同应用场景中拓展和强化酶的应用潜力。
该研究得到了国家自然科学基金及广东省自然科学基金等项目的支持。