朱伟教授团队在Journal of Controlled Release发表论文—通过光敏剂驱动疏水药物实现组装-解组装的纳米药物用于增效三阴性乳腺癌的治疗
近日,华南理工大学生物科学与工程学院朱伟教授联合广州医科大学附属第二医院雷琪教授在国际著名期刊Journal of Controlled Release(IF=10.8)杂志上在线发表题目为“Spatiotemporally-controlled hydrophobic drug delivery via photosensitizer-driven assembly-disassembly for enhanced triple-negative breast cancer treatment”的研究论文。华南理工大学生物科学与工程学院博士研究生孔繁晖为第一作者。
论文链接:https://doi.org/10.1016/j.jconrel.2024.03.035
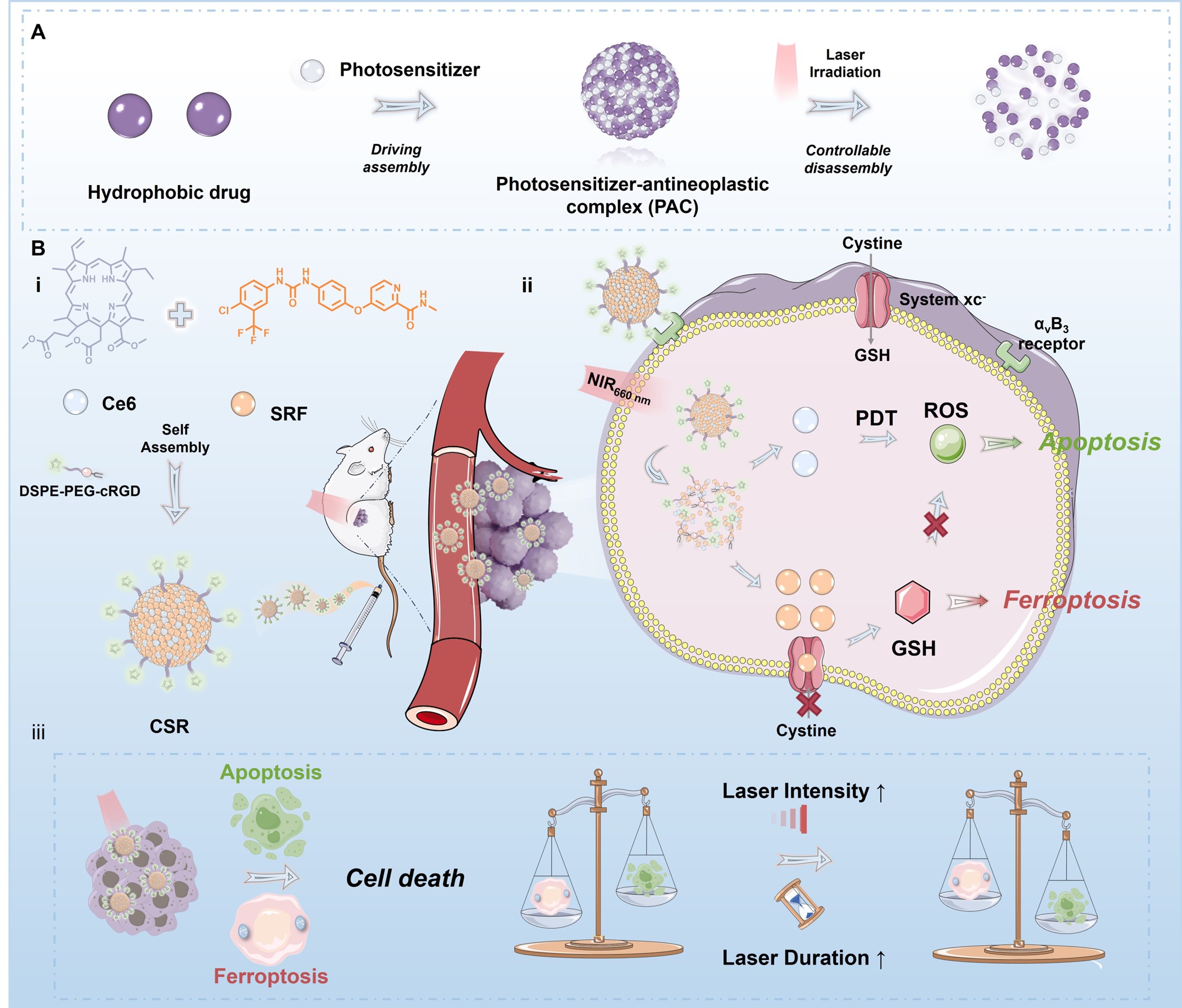
图1.时空控制的疏水性抗肿瘤药物递送系统(SCHADS)用于增效三阴性乳腺癌。
纳米药物作为抗肿瘤的“生物导弹”被生物医药企业寄予厚望,并吸引了全世界数以万计的科学家及每年数十亿美元研究经费投入到该领域的研究。尽管大量的抗肿瘤纳米药物在临床前动物肿瘤模型中取得了巨大成功,但只有极少数的抗肿瘤纳米药物在临床肿瘤病人上显出优势。因此,基于实现减少化疗副作用以及增强疗效的临床转化是研究纳米药物的最终目标。
三阴性乳腺癌(TNBC)是恶性程度最高的肿瘤之一,具有侵袭性高和易产生耐药性等特点。目前美国FDA已批准数种疏水性药物用于TNBC的治疗,他们通常被装载在纳米载体中以减少对正常组织的不良反应。但是由于药物利用率不高和肿瘤靶向性不足等问题,目前纳米药物的治疗效果被极大地限制。尽管一线化疗药物可通过共沉淀法得到具有载药能力高的纳米药物,但存在组装过程和体内释放行为不易调控等问题。因此,迫切需要构建一种高度可控释放、能提高药物可用性以及具有精准肿瘤靶向能力的纳米药物,以更好地发挥TNBC的治疗效果并具有临床转化能力。
在本研究中,我们提出一种具有通用性的策略——以光敏剂驱动的组装-解组装的药物递送系统(SCHADS),用于增效三阴性乳腺癌。该系统的核心在于通过光敏分子驱动疏水性药物自组装形成亚稳定的光敏-抗肿瘤药物复合物(PAC),而PAC的解组装可通过光控调节(激光强度和照射时间),避免药物的过早释放,使抗癌药物在肿瘤部位实现原位释放,进而提高药物可用性。此外光敏剂产生的活性氧(ROS)可有效地杀伤肿瘤细胞,最终实现光动力学与化疗的协同治疗。为阐明SHCADSD的设计和探究其治疗效果,我们选择了具有20个电子卟啉环、可提供强大π-π堆叠作用的二氢卟吩(Ce6)作为光敏分子,驱动抗癌药物索拉非尼(SRF)自组装形成PAC,进一步地修饰肿瘤靶向肽以克服肿瘤靶向效率不足的障碍。研究结果显示上述PAC在无光照时保持亚稳态,而在激光照射下可在肿瘤部位高效分解,释放出system xc-抑制剂SRF和大量的ROS;在体内外实验中,PAC显示出优异的抗肿瘤效果。与其同时,通过调整光照条件,细胞的死亡方式(细胞凋亡和铁死亡)可实现有效操控,这为规避肿瘤的固有与获得性耐药提供了巨大潜力。在本研究中,我们设计的以光敏剂驱动疏水药物组装-解组装的纳米药物递送系统(SCHADS)具有通用性和便利性,在实现超高的载药率的同时可以显著规避药物不可控释放和脱靶等问题,进而提高抗癌药物在肿瘤部位的可用性并实现TNBC的协同治疗。
该研究得到了国家自然科学基金(22372061, 52003086, 21972047)及广东省自然科学基金(2021A1515010724, 2021A1515220051, 2022A0505050008)等项目的支持。