科学研究
科学研究





 2022-06-17
2022-06-17 2984
2984
华南理工大学自旋科技研究院院汪志义副教授与北京大学侯仰龙教授合作,制备了一种温度和肿瘤微环境双响应的介孔磁性纳米微球用于构建一种生物成像介导的智能药物递送系统,在交变磁场下可以实现化疗与化学动力学疗法(chemodynamic therapy, CDT)的协同治疗,在癌症的一体化诊疗的研究中展现出重要的发展潜力。

基于工程纳米材料的智能药物递送系统(smart drug delivery systems, SDDSs)的开发已显示出重要的临床应用前景。这些SDDSs显示出一些明显的优势,主要包括能在疾病的病变部位富集更多的药物、增强细胞摄取能力、延长体内循环时间、提高系统稳定性以及减少胶囊化合物对健康组织的毒副作用等。然而,深层肿瘤化疗药物的可控给药以及避免在递送过程中因脱靶而引起的毒副作用仍然面临巨大的科学挑战。
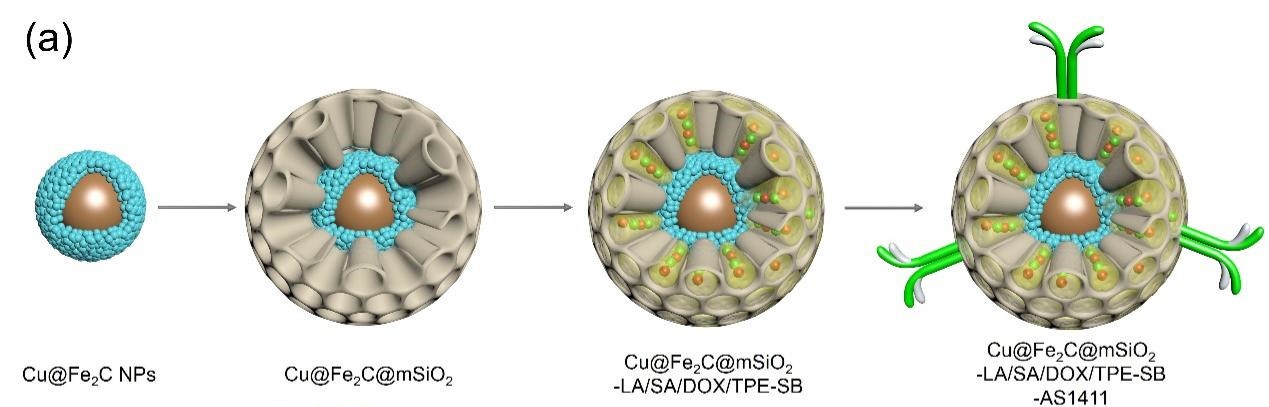
图1磁致热效应诱导的温度和肿瘤微环境双响应的SDDSs的设计示意图
如图1所示,在通过合理的纳米结构设计后,该研究团队制备了一种温度和肿瘤微环境双响应的可降解的SDDSs(Cu@Fe2C@mSiO2-LA/SA/DOX/TPE-SB-AS1411)。以介孔磁性纳米微球Cu@Fe2C@mSiO2作为药物递送的纳米载体,利用二元复合相变材料月桂酸/硬脂酸(LA/SA)对化疗药物阿霉素(DOX)和AIE分子(TPE-SB)进行封装,在实现DOX的温敏可控释放的同时,还能促进TPE-SB分子的聚集诱导发光,实现荧光成像与磁共振成像的有机结合,有望实现小鼠体内给药过程的影像监控。再利用核酸适配体AS1411对上述纳米微球进行表面修饰,从而可以实现4T1荷瘤小鼠的肿瘤主动靶向。

图2 SDDSs在肿瘤细胞内上调•OH水平的定性和定量检测及其内在机制揭示
SDDSs在交变磁场作用可以产生磁致热效应,产生的热可以使介孔中封装的二元复合相变材料LA/SA由固相转变为液相,从而促进药物分子向外扩散。由于交变磁场的作用具有不受肿瘤深度的限制。因此,只要SDDSs能够进入深层肿瘤,就能实现深层肿瘤中DOX的可控释放。此外,该SDDSs在降解后对(类)芬顿反应具有高效的催化活性,可以显著上调4T1细胞中的羟基自由基(•OH)水平。产生的•OH会诱导STAT3磷酸化的上调,即提示STAT3信号通路的激活(图2)。STAT3信号通路已被证明与细胞凋亡有关,所以该结果可以提供降解后的SDDSs在肿瘤微环境中通过CDT过程后杀伤肿瘤的一条路径。解后的SDDSs最终可以代谢出体外,我们通过生物成像与代谢物分析实验进行了验证。
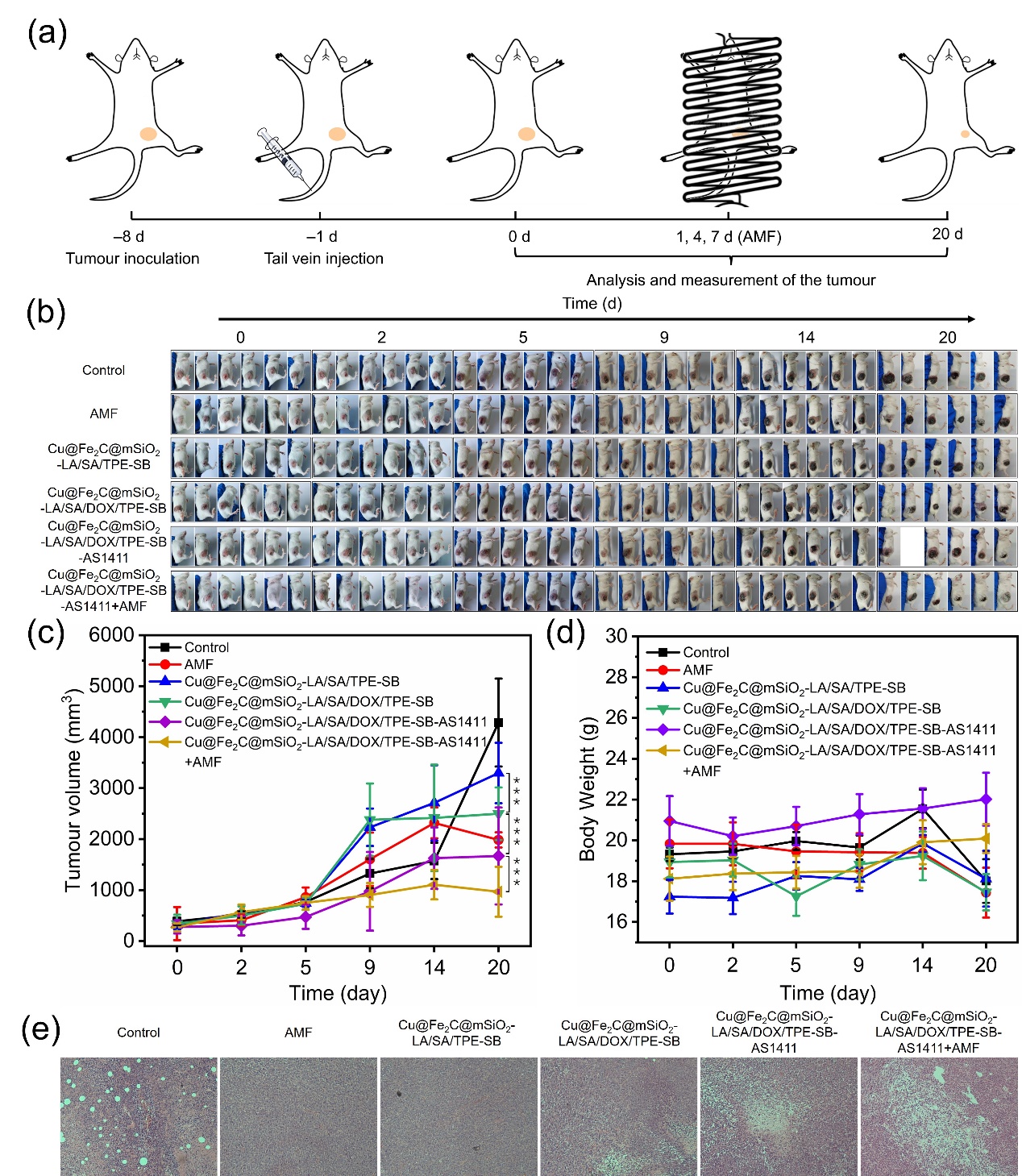
图3 SDDSs用于体内抗肿瘤化疗-化学动力学治疗
通过对4T1荷瘤小鼠进行化疗-化学动力学疗法的联合治疗方法设计,最终实现了癌症治疗效果的协同增强(图3)。综上所述,该研究为癌症的一体化诊疗提供了一种个性化治疗策略。此项研究得到了国家自然科学基金(52027801, 51631001, and 52001008)、国家重点研发计划(2017YFA0206301)、北京市自然科学基金(2191001)和中德合作项目(M-0199)的支持。该工作以research article的形式发表在CCS Chemistry,已在官网“Just Published”栏目上线。
论文链接:https://www.chinesechemsoc.org/doi/10.31635/ccschem.022.202201805