实验室周城教授&冯光雪教授团队:基于可嵌膜的共轭齐聚电解质分子的光激活机械疗法
癌症治疗长期面临耐药性挑战,传统疗法常因肿瘤细胞修复机制、药物外排泵激活等限制疗效。光动力疗法(PDT)和光热疗法(PTT)虽具精准优势,但肿瘤抗氧化防御与热休克蛋白上调仍可削弱其效果。
针对这一困境,近日,华南理工大学发光材料与器件全国重点实验室周城教授团队与冯光雪教授团队及新加坡南洋理工大学GuillermoC.Bazan教授合作,创新性地利用膜仿生共轭齐聚电解质(COEs),开发出一种光触发分子机械疗法,通过物理破坏癌细胞膜结构规避耐药机制,为肿瘤治疗提供了新策略。
本研究开发了一种基于膜仿生共轭齐聚电解质(COE)的光控分子机械疗法,利用低剂量白光(20 mW/cm²,10分钟)激活可嵌入细胞膜的COE分子BT,实现对癌细胞的快速物理杀伤。其作用机制经验证独立于传统光疗途径:通过活性氧清除实验(ROS清除剂处理前后BT对细胞杀伤率一致)和光热效应排除实验,证实该效应非光动力或光热作用所致。结合原位X射线衍射观测到膜厚度从3.5nm减薄至2.9 nm的结构变化,以及飞秒瞬态吸收光谱检测到时间常数为~5 ps的分子构象变化新物种,共同证实该效应源于光控机械力作用。
BT在黑暗条件下表现出优异生物相容性(IC₅₀ >256 μM),而在光照下展现出强效癌细胞杀伤能力——在A549肺癌细胞中使半抑制浓度骤降至0.6 μM,活性提升超400倍。该疗法通过机械力诱导的细胞焦亡通路发挥协同治疗作用:BT的光激活不仅直接破坏细胞膜,更触发caspase-1介导的焦亡过程。动物实验证实,经BT治疗的4T1荷瘤小鼠肿瘤体积显著抑制,同时伴随肿瘤内CD8⁺ T细胞浸润增加及血清TNF-α/IFN-γ水平升高,系统性激活了抗肿瘤免疫应答,为克服癌症耐药性提供了新策略。
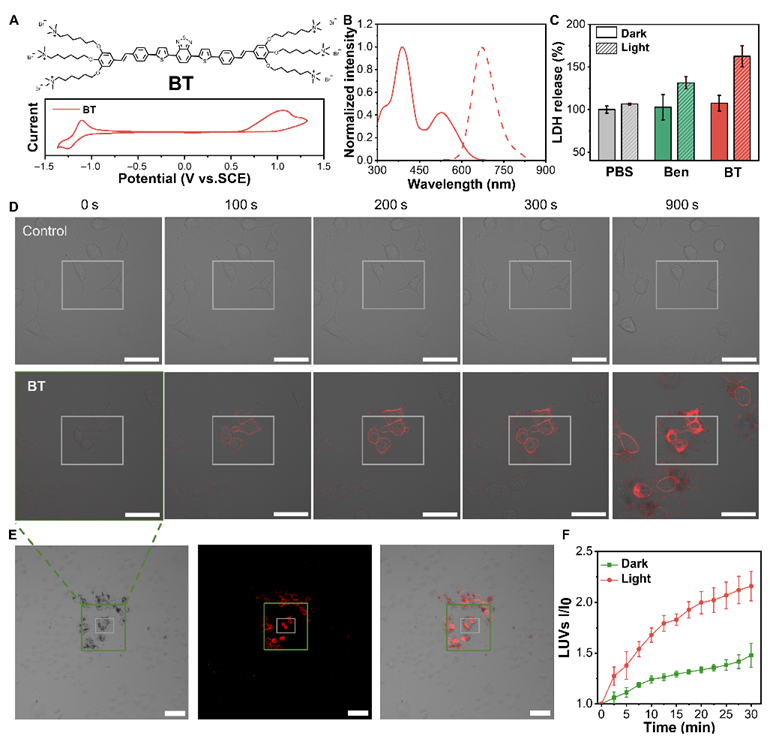
图1. 光触发的膜嵌入和 BT 的膜破坏
相关研究成果以“Light-triggered Molecular Mechanotherapy of Tumor UsingMembrane-mimicking Conjugated Oligoelectrolytes”为题发表在Science Advances上,其中通讯作者为华南理工大学周城教授、冯光雪教授和新加坡南洋理工大学GuillermoC. Bazan教授,第一作者为华南理工大学周佩蓉博士生和张迪博士生。该研究工作得到了国家自然科学基金等科研项目的资助。
原文链接
https://doi.org/10.1126/sciadv.ady3349


