实验室黄飞教授团队:基于膜模拟的共轭电解质分子木马用于刺激响应性药物释放
药物递送系统在现代药物研发中具有重要意义。为了提高治疗效果,除了确保药物在到达目标前的稳定性外,控制药物的释放同样至关重要。近年来,外源性刺激已成为调控药物释放的热门选择,其中光控系统由于其空间和时间的精准控制,广受关注。然而,现有的光控药物递送系统面临着稳定性不足、药物泄漏等挑战,亟需更稳定且可控的解决方案。
近日,华南理工大学发光材料与器件全国重点实验室黄飞教授、周城教授团队与南方科技大学李凯教授团队合作,在这一领域取得了重要突破。他们设计并合成了一种名为Zwit的两性离子共轭电解质(Conjugated Electrolyte,CE)分子,成功解决了药物递送系统中的关键难题。
本研究介绍了一种末端引入两性离子基团的近红外二区(NIR-II)共轭电解质分子Zwit。该分子能够通过模拟脂质双层结构,稳定地嵌入脂质体膜中。Zwit的引入增强了脂质体膜的刚性,进而有效地防止药物如DOX的提前释放。然而,在808 nm激光照射下,会加速DOX释放,这可能是由于光诱导的Zwit分子构象变化或光热效应导致的膜通透性增加。这一特性使得Zwit不仅具备良好的药物封装稳定性,同时又能通过外部光刺激实现精确的药物释放,克服了以往药物递送系统中常见的两难问题。此外,与常见的ICG染料相比,Zwit在脂质体膜中的结合更为稳定,能够有效避免药物和染料的泄漏问题,并实现精准的体内成像。这使得Zwit在药物递送过程中不仅具备稳定性,还可以为实时追踪药物分布提供有力支持。在动物实验中,Zwit不仅改善了药物递送效果,还通过光热治疗、化疗和抗肿瘤免疫治疗的协同作用,显著提升了抗癌疗效。
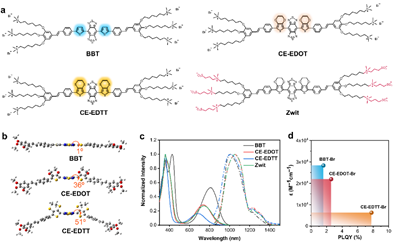
图1 分子设计和合成
通过这项研究,Zwit展示了作为药物递送系统中“分子木马”的独特优势,能够模拟并整合到脂质膜中,在到达靶点之前保持药物包封稳定性,同时实现可控和刺激响应的药物释放,以及提供给药系统在体内的实时生物分布数据,为未来的精准医学和肿瘤治疗提供了新的方向。这项研究展示了膜嵌入共轭电解质在药物递送系统中的巨大潜力。
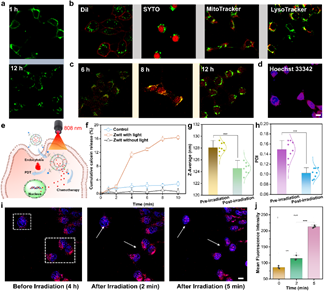
图2 近红外光引发的药物释放
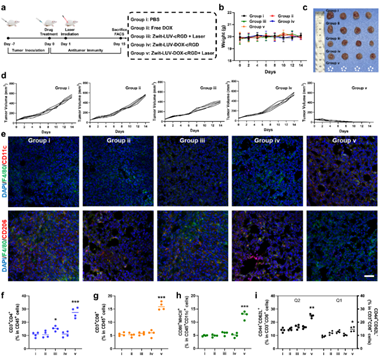
图3 体内抗肿瘤治疗
相关研究成果以“MolecularTrojan Based on Membrane-Mimicking Conjugated Electrolyte forStimuli-Responsive Drug Release”为题发表在《Advanced Materials》期刊上,其中通讯作者为黄飞教授,周城教授和南方科技大学李凯教授,第一作者为孟莹莹博士生和高继博士生。该研究工作得到了广东省基础与应用基础研究基金(2024A1515011732)、国家自然科学基金(52303229,52394273,U21A2097)以及中国科技部(2023YFF0715400)的支持。
原文链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/adma.202415705


