王均教授、都小姣教授和杨显珠教授合作在Nano Today期刊上发表最新研究成果
近日,华南理工大学王均教授、都小姣教授和杨显珠教授团队在国际学术期刊《Nano Today》发表了以“Two-step screening of lipid-polymer nanoparticles for efficient mRNA vaccine delivery and cancer immunotherapy”为题的研究论文。华南理工大学为论文的第一署名单位,博士生黄梦文为论文的第一作者,王均教授、都小姣教授和杨显珠教授为共同通讯作者。
mRNA疫苗无疑是药物研发领域的一项重大医学突破,然而,其临床应用高度依赖于能够将mRNA递送至靶组织和细胞的载体系统。目前临床批准的脂质纳米粒(LNP)存在明显的肝脏富集特性,限制了其广泛应用。针对这一挑战,研究团队创新性地开发了一种基于临床已批准药用辅料的新型脂质-聚合物纳米颗粒(LPP),通过两步体内筛选策略优化LPP的递送效率,用于高效递送mRNA疫苗并实现有效的癌症免疫治疗。
该研究首先利用临床已批准的阳离子脂质、可电离脂质和两亲性聚合物PEG-b-PLGA,构建了一个包含60种不同配方的初始LPP库,并通过体内递送表达萤火虫荧光素酶的mRNA,筛选出递送效率高的配方;进一步构建了包含15种配方的次级库进行第二轮的优化筛选。最终获得的优化LPP配方的体内mRNA递送效率相比初始最低效配方提升了近1000倍,并显著降低了mRNA在肝脏中的表达。
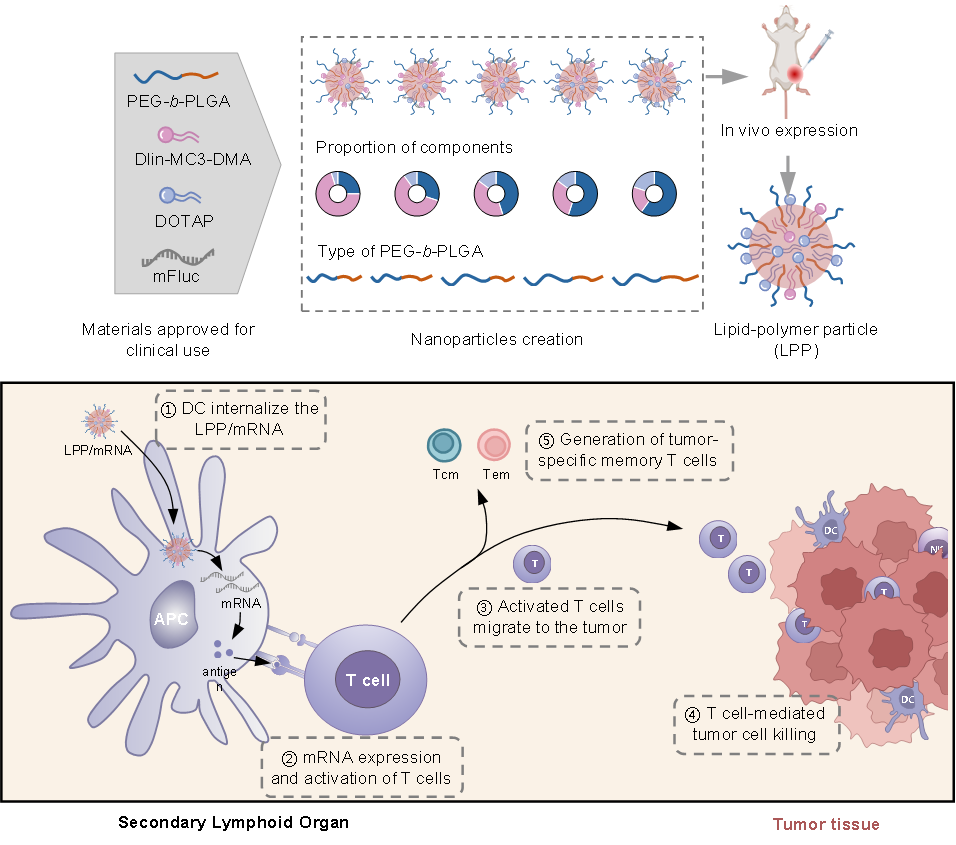
研究显示,筛选出的优化LPP能有效将mRNA递送至抗原呈递细胞,激活免疫效应细胞,触发Th1/Th2免疫反应,并促进抗原特异性免疫记忆T细胞的形成。在B16F10-OVA黑色素瘤模型和人乳头瘤病毒(HPV)相关的TC-1肿瘤模型中,负载mRNA疫苗的LPP均表现出强大的抗肿瘤效果,其静脉注射后的治疗活性与临床批准的LNP相当,且未引起明显的毒性反应。更重要的是,相比于LNP,LPP/mRNA疫苗在诱导树突状细胞激活以及抗原特异性T细胞和记忆T细胞的形成方面表现出更优的能力,提示其具备更强的细胞免疫应答潜能。
该工作为开发高效、安全且具有临床转化潜力的mRNA递送系统提供了一种创新范式,避免了引入新型合成材料带来的不确定性,显著提升了临床转化的可行性。
该研究得到了国家重点研发计划、国家自然科学基金、广州市重点研发计划及广州国家实验室重大项目等资助。
论文链接:https://doi.org/10.1016/j.nantod.2025.102943
