团队发展用于递送胞外靶点药物的递送系统
目前,随着新型抗肿瘤药物或候选药物的不断开发,靶点位于胞外的抗肿瘤药物不断涌现。如基质金属蛋白酶抑制剂类药物(巴马司他等)和绝大部分单抗类药物aPD-L1、aPD-1、aCTLA-4等。与胞内靶点药物不同,这些药物的作用靶点在胞外,必须递送它们到达肿瘤胞外靶点才能发挥其抗肿瘤效应。而尺寸在50~200 nm的传统纳米载体递送药物到达肿瘤部位易被肿瘤相关细胞摄取,导致药物进入胞内被降解而失效;此外,研究表明纳米载体经系统给药后虽然大部分纳米载体能到达肿瘤部位(~70%),但是纳米载体很快又会经血液或淋巴系统被代谢清除掉,造成只有少量纳米载体能滞留在肿瘤部位(~0.7%),导致最终疗效不佳。
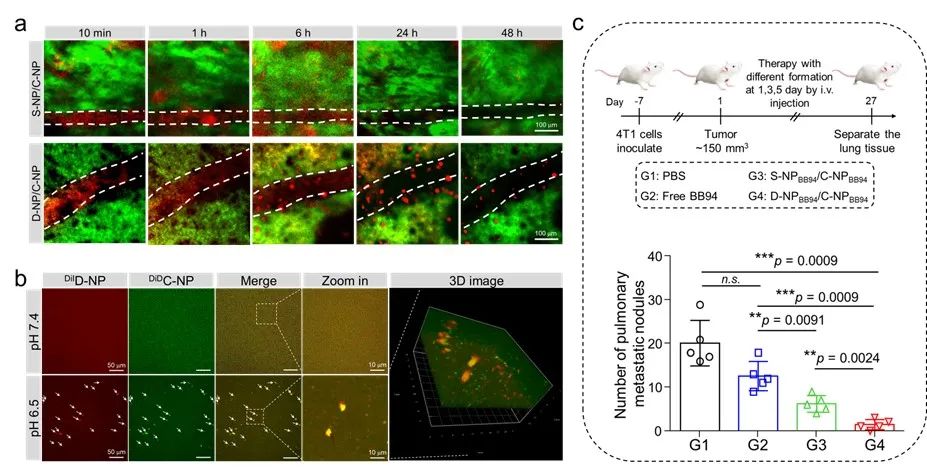
近日,华南理工大学杨显珠教授课题组构建了一种用于胞外靶点药物的递送体系,该体系由两种纳米粒(D-NP和C-NP)构成。D-NP/C-NP经系统给药可在肿瘤部位发展颗粒间的生物正交反应,增强纳米载体在肿瘤部位的富集和滞留,避免药物被肿瘤相关细胞摄取,可用于递送胞外靶点药物。
实验结果表明,该D-NP/C-NP纳米载体经系统给药后能在肿瘤部位发生交联聚集,增强纳米载体及药物在肿瘤部位的富集和滞留,且两颗粒在肿瘤部位具有良好的共定位;该体系递送胞外靶点药物巴马司他(BB94)在体内取得了良好的抗肿瘤转移功效。综上所述,这种肿瘤原位组装的纳米载体系统可用于递送胞外靶点药物。
该成果以“Bioorthogonal in situ assembly of nanomedicines as drug depots for extracellular drug delivery”为题发表在国际期刊Nature Communications, 2022, 13, 2038上。曹紫洋博士为论文第一作者。文章链接https://www.nature.com/articles/s41467-022-29693-8。
