团队在纳米药物调控肿瘤免疫微环境方面取得最新研究进展
纳米颗粒递送蒽醌类等化疗药物能够增强药物在肿瘤组织的积累,增强肿瘤细胞发生免疫原性细胞死亡(ICD),提高肿瘤免疫原性,从而促进树突状细胞成熟,激活抗肿瘤免疫。然而,这种方法产生的抗肿瘤免疫应答往往不足以抑制肿瘤的生长,因此需要联合其他免疫治疗方法,例如PD1/PD-L1阻断疗法,以协同改善抗肿瘤免疫反应。一些研究分析了肿瘤微环境中包括DC、T细胞等在内的关键免疫细胞的比例和功能,证明了联合治疗在抗肿瘤免疫方面的优势。然而,两种疗法联用的原则仍需进一步探索。因此,深入全面的了解纳米药物治疗后的肿瘤免疫景观,有助于解析纳米药物调控肿瘤微环境的机制,明确纳米药物治疗与免疫疗法相结合的合理性,提高联合治疗的疗效。
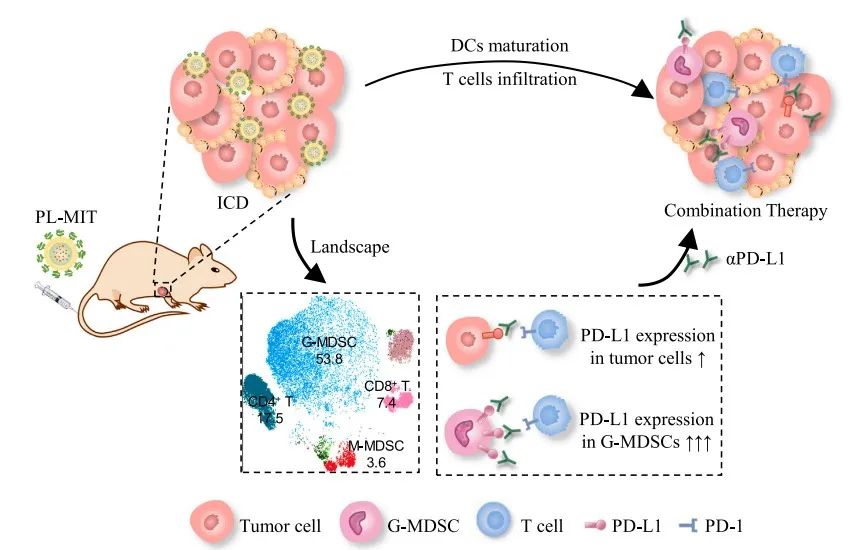
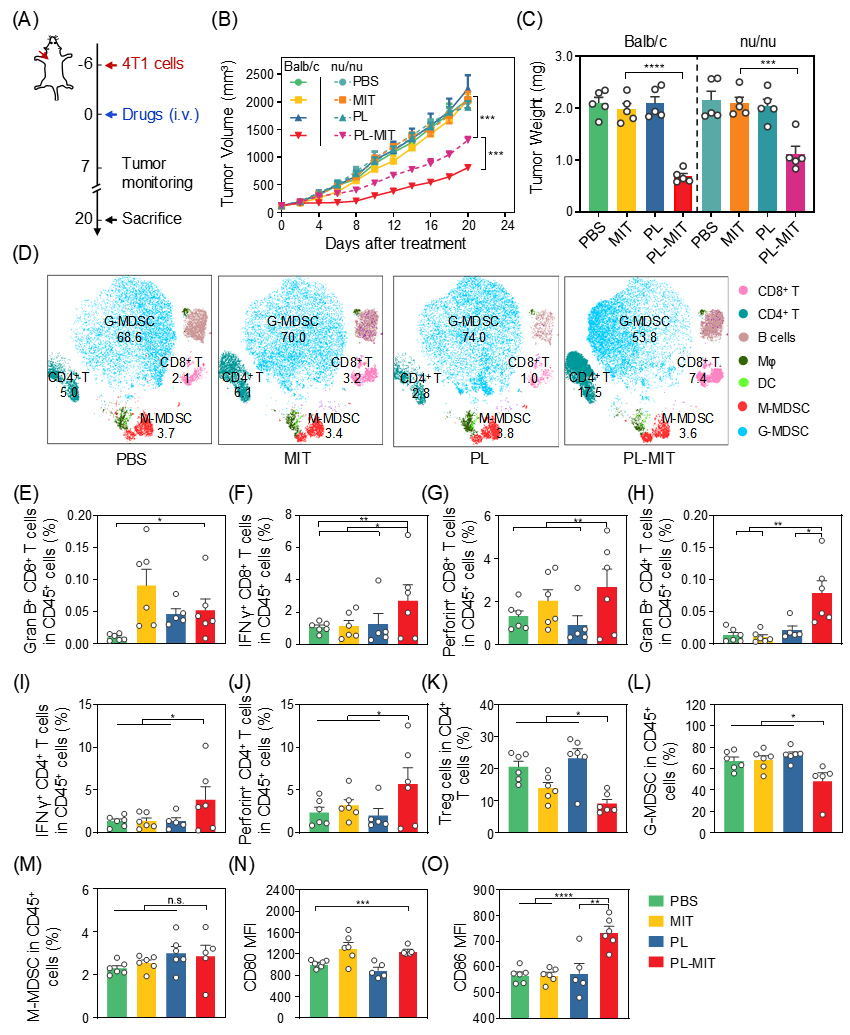
基于此,研究团队以被国家食品药品监督管理局批准上市的米托蒽醌脂质体(PL-MIT)作为模型纳米药物,系统地评估了其治疗后的肿瘤免疫微环境状态。发现仅静脉注射一次PL-MIT后,即能够改善米托蒽醌(MIT)的体内生物分布,增强肿瘤组织的ICD效应,活化树突状细胞,增强细胞毒性T淋巴细胞的比例和功能,降低免疫抑制性细胞的比例。然而,随着药物剂量的提高,药效增加不明显。进一步地分析显示,PL-MIT治疗也明显提高了肿瘤细胞、髓源性抑制细胞(MDSC),尤其是是粒细胞样MDSC(G-MDSC)的PD-L1的表达,从而限制了抗肿瘤免疫的效果,将其与anti-PD-L1抗体联用能够进一步增强抗肿瘤效果。该研究从体内解析纳米药物对肿瘤微环境的调控方面为纳米药物与肿瘤免疫治疗的联合使用提供参考。
研究成果以“Pegylated liposomal mitoxantrone modulates tumor immune landscape to boost PD-L1 blockade therapy”为题发表在纳米科技领域著名学术期刊Nano Today,全文链接https://doi.org/10.1016/j.nantod.2022.101500。
