华南理工大学袁友永教授课题组在Acta biomaterialia 杂志上发表最新研究成果
2022年01月24日,国际学术期刊Acta biomaterialia在线发表了袁友永教授课题组以“Tumor-Acidity and Bioorthogonal Chemistry-Mediated Construction and Deconstruction of Drug Depots for Ferroptosis under Normoxia and Hypoxia”为题的论文。华南理工大学为论文的第一署名单位,周洁莲和王可伟为论文的共同第一作者,袁友永教授为论文的通讯作者。华南理工大学为论文第一署名单位和通讯单位。该研究得到了中国国家自然科学基金会、广州市科技计划项目、广东省“珠江人才计划”等项目的支持。
由于实体肿瘤中癌细胞快速增殖,血管发育不完全且分布不均匀,实体肿瘤内部氧气供应不足,导致肿瘤中存在乏氧区域。许多证据表明,肿瘤乏氧不仅会加速肿瘤的侵袭和转移,而且还会诱发治疗性耐药。非氧气依赖的芬顿反应通过铁离子催化内源性过氧化氢(H2O2)转化为氧化性更强的羟基自由基(•OH),被广泛用于铁死亡治疗研究。然而,肿瘤细胞内H2O2的含量有限,影响了治疗效果。
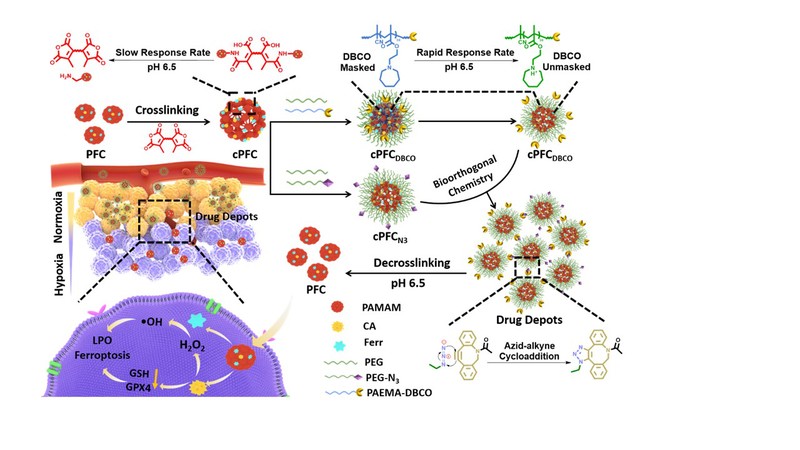
针对上述问题,我们设计了一个肿瘤酸性和生物正交化学介导的铁死亡药物库,实现了在常氧和乏氧条件下诱导肿瘤细胞铁死亡。该体系中,肉桂醛(CA)可以消耗GSH并升高胞内H2O2,将CA和芬顿反应催化剂二茂铁(Ferr)修饰到聚酰胺-胺型树枝状高分子(PAMAM,G4),得到尺寸约10 nm的纳米芬顿反应器PAMAMFerr/CA(PFC)。然后,用马来酸酰胺(CDM)交联PFC得到初始尺寸约为100 nm的纳米颗粒cPFC。进一步地,分别用聚(2-氮烷甲基丙烯酸乙酯)二苯并环辛炔(PAEMA-DBCO)和COOH-PEG2K-N3修饰得到cPFCDBCO和cPFCN3。在肿瘤酸性环境中,PAEMA快速从疏水转变成亲水,暴露出cPFCDBCO上的DBCO基团,与cPFCN3的N3基团发生生物正交反应形成大尺寸的交联体(约1000 nm),增强了纳米药物在肿瘤组织的富集与滞留。由于CDM在肿瘤酸性环境中会被缓慢裂解,因此cPFCN3和cPFCDBCO的交联体可以被看作药物仓库,在肿瘤酸性环境中不断释放出小尺寸的PFC,渗透到远离血管的乏氧区域,从而实现在常氧和乏氧条件下均可H2O2自供给诱导肿瘤细胞铁死亡。
综上所述,本研究利用肿瘤酸度和生物正交点击化学结合构建药物库,为肿瘤治疗提供了一种增强肿瘤滞留和渗透的通用给药策略。
全文链接https://doi.org/10.1016/j.actbio.2022.01.046