杨显珠实验组在Adv. Funct. Mater.报道了近红外光超快激活的TAT靶向纳米体系
日期:2017-12-08
抗肿瘤纳米药物载体通常利用靶向分子修饰,从而通过肿瘤细胞表面受体介导,实现药物的靶向递送。然而,需要指出的是,不同类型肿瘤细胞或同一类型不同病人的肿瘤细胞表面受体表达不同;即使是同一个病人,在肿瘤发展不同阶段,其表面受体表达同样不同。这种肿瘤异质性制约了纳米载体的靶向药物递送。与受体介导的靶向递送体系不同,细胞穿膜肽TAT是一类从艾滋病病毒中筛选出的短肽序列,不依赖与细胞表面受体即靶向递送药物至多种细胞。但是,这种TAT多肽修饰后的纳米药物,易于被免疫系统识别而快递清除。为了克服这一难题,王均教授与杨显珠教授曾利用2,3-二甲基马来酸酐(DA),修饰TAT多肽的KK侧链氨基,从而避免在血液循环过程中被免疫系统识别,到达肿瘤部位后,肿瘤微酸性环境重新激活生成TAT序列,增强被肿瘤细胞的摄取,这一研究成果发表在以“Tumor Acidity/NIR Controlled Interaction of Transformable Nanoparticle with Biological Systems for Cancer Therapy”为题发表在Nano Letters, 2017, 17, 2871–2878(2016影响因子: 12.712)。。
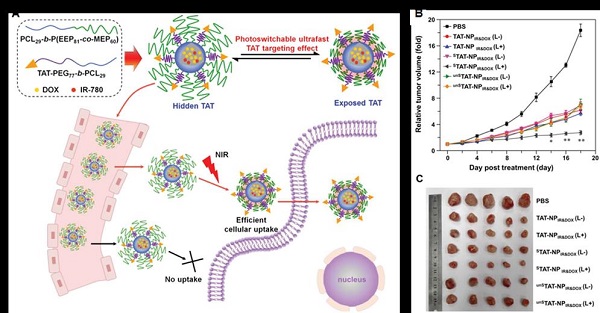
在上述研究的基础上,杨显珠实验组进一步设计了近红外光超快激活的TAT靶向纳米药物载体STAT-NPIR&DOX:该纳米体系疏水内核由聚己内酯构成,包载了光敏剂IR-780和化疗药物DOX;其亲水壳层由长链的温敏性聚磷酸酯和短链的PEG构成,其中PEG末端键合了靶向分子TAT(图1A)。静脉给药后,STAT-NPIR&DOX的TAT靶向分子被长链聚磷酸酯屏蔽,避免免疫系统识别,实现长循环,同时避免正常组织细胞摄取而造成毒负作用;当STAT-NPIR&DOX到达肿瘤部位后,近红外光照射导致包载的IR-780在纳米颗粒周围产生光热效应,诱导温敏性聚磷酸酯的塌陷,60 s内即可超快实现TAT靶向分子重新暴露,增强肿瘤细胞摄取,提高抗肿瘤效果(图1B和图1C)。这种近红外光调控的TAT靶向效应可以应用到多种按需给药体系中。研究成果以“Photoswitchable Ultrafast Transactivator of Transcription (TAT) Targeting Effect for Nanocarrier-Based On-Demand Drug Delivery”为题发表在国际著名学术期刊Advanced Functional Materials, 2017, 1704806(2016影响因子:12.124),论文链接http://onlinelibrary.wiley.com/doi/10.1002/adfm.201704806/full。
该研究得到了科技部重大研发计划项目(National Key R&D Program of China,2017YFA0205601),国家自然基金委面上项目(51473043和51773067)等基金的支持。(图文/生命科学研究院)
