
胰腺导管腺癌(Pancreatic ductal adenocarcinoma, PDAC)是一种恶性程度极高的消化系统肿瘤,早诊难,一旦发病,进展迅速,总体手术切除率低、术后复发率或转移发生率高,预后极差,总体5年生存率仅为4.1%,被称为“癌中之王”。以吉西他滨为基础的传统核苷类似物化疗药物是胰腺癌治疗的中流砥柱,但其作用有限。胰腺癌除了高度异质性、丰富的间质组织,复杂的基因突变更是胰腺癌药物研发面临的一大挑战。研究表明,大约70%的PDAC患者具有TP53基因突变,大约90%的PDAC患者具有KRAS基因突变。KRAS和TP53的共突变在PDAC的发生和发展中起着关键的驱动作用。因此,靶向突变KRAS或突变p53有望成为一种极具前景的治疗方法。已有文献表明突变型p53与突变KRAS致癌信号轴之间存在紧密的联系,共同促进胰腺癌的生长、转移和免疫抑制。因此,针对多个关键驱动癌基因的联合治疗方法可能为胰腺癌治疗带来希望。
鉴于此,华南理工大学张云娇教授研究团队开发了一种近红外发光双功能纳米颗粒,名为P6@siKRAS,该纳米粒子由近红外发射的吡咯自由基阳离子(P6•+)和KRAS siRNA组成。该研究首次揭示了P6•+以K48泛素化蛋白酶体依赖的方式有效地触发突变p53降解。研究结果显示,P6@siKRAS有效地清除胰腺癌细胞中突变p53和致癌KRAS蛋白。这种创新的双调控治疗策略逆转了突变p53的获得性新功能并抑制了KRAS调节的下游信号通路,在双突变胰腺癌肿瘤模型中均显示出显著的治疗效果,为p53-KRAS双突变胰腺癌治疗提供了新的思路。
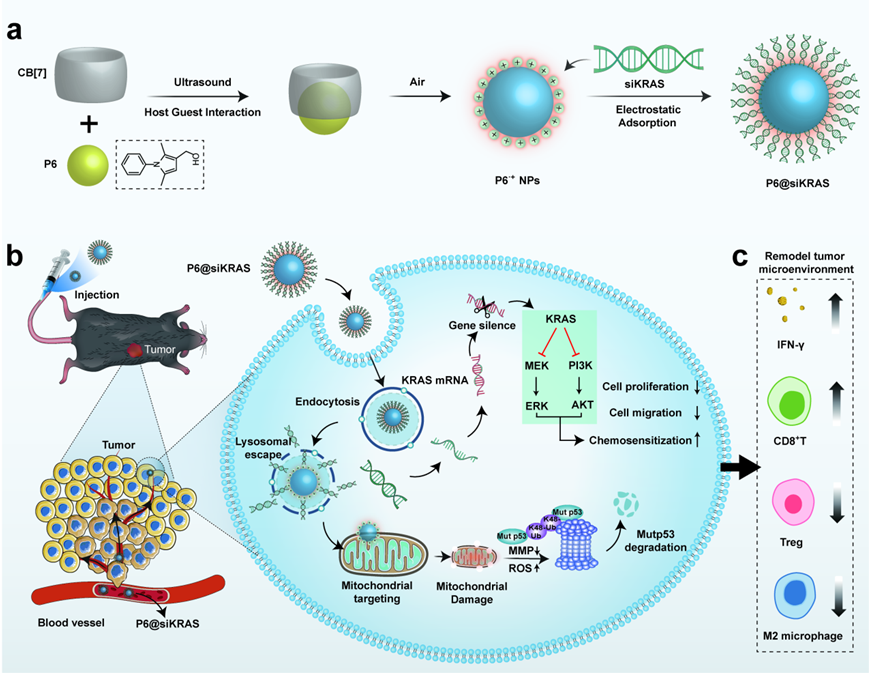
本文要点
(1)本研究首次发现2,5-二甲基-1-苯基-1H-吡咯衍生物在酸性环境下迅速转化为近红外发光的吡咯自由基阳离子后可以显著降解肿瘤细胞中的突变p53蛋白。利用静电吸附作用原理,研究者成功构建了双功能纳米颗粒P6@siKRAS,该纳米颗粒具有时空调控突变p53-KRAS蛋白质稳态的优越性能,在双突变胰腺癌细胞中同时清除突变p53/KRAS蛋白。
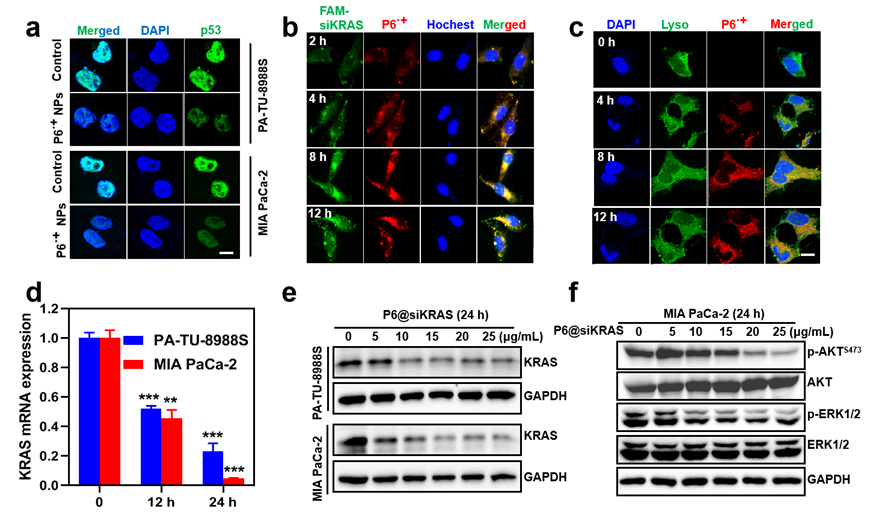
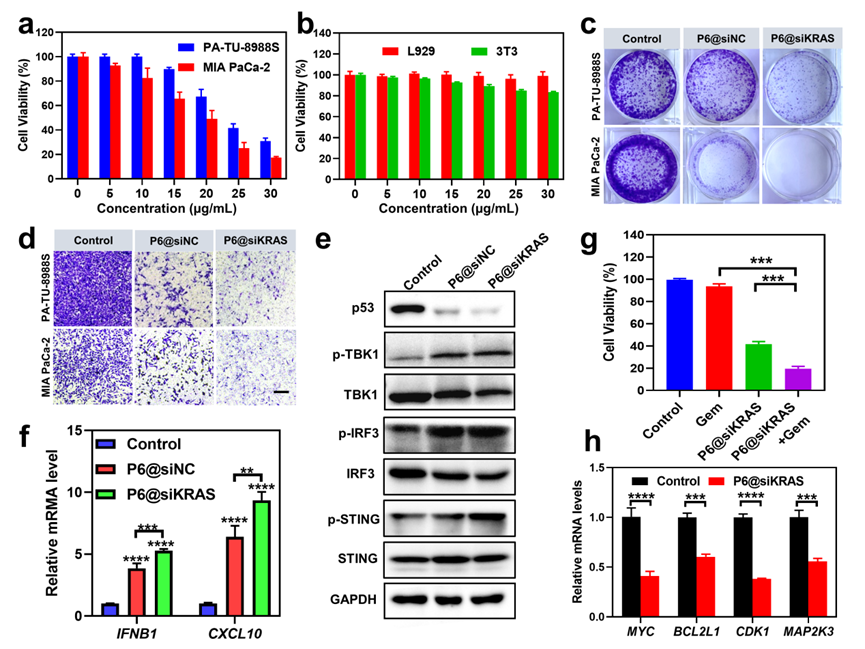
(2)P6@siKRAS双清除肿瘤细胞中的突变p53及突变KRAS蛋白后,解除了突变p53的获得性功能并抑制KRAS下游信号通路,包括抑制细胞增殖、迁移、耐药及激活固有免疫系统等,从而诱导癌细胞的死亡。
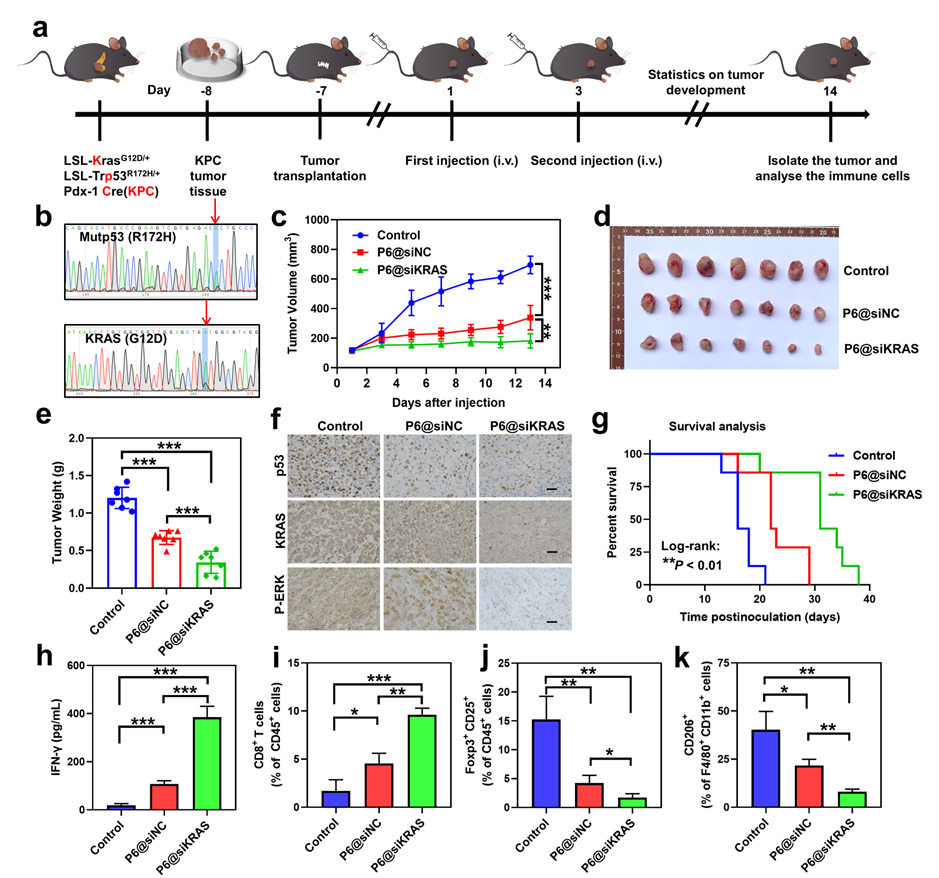
(3)体内实验结果表明,P6@siKRAS双功能纳米颗粒在MIA PaCa-2双突变胰腺癌模型和LSL-KrasG12D/+; LSL-Trp53R172H/+; Pdx-1-Cre (KPC)自发胰腺癌模型中具有优异的抗肿瘤疗效。更重要的是,P6@siKRAS通过清除突变p53和突变KRAS蛋白,增强了肿瘤微环境中CD8+ T细胞的浸润水平,重塑了肿瘤免疫微环境,从而显著抑制肿瘤生长。
综上所述,该研究发展了一种具有降解突变p53的功能性基因递送载体,并设计了双功能纳米颗粒,可同时调控突变p53/KRAS蛋白稳态,为胰腺癌的精准治疗提供了新的策略。
本工作以“NIR Emissive Functional Nanoparticles Promote Precise Pancreatic Cancer Therapy by Co-targeting Mutant p53 and Oncogenic KRAS ”为题,发表在国际著名期刊Advanced Functional Materials(Adv. Funct.Mater. 2024, 2312610)。论文的共同第一作者是华南理工大学钱洁颖博士后、杨振宇博士研究生和张旺硕士研究生,论文通讯作者为华南理工大学张云娇教授,华南理工大学为论文的第一单位。
全文链接:https://doi.org/10.1002/adfm.202312610
