免疫治疗是近年来备受瞩目的一类新兴肿瘤治疗策略,并因其在恶性肿瘤治疗方面取得的重大进展而被誉为是人类最有希望攻克癌症的手段之一。然而,免疫治疗也存在明显的临床局限,因此,寻求新的肿瘤免疫治疗手段或方法已迫在眉睫。免疫原性细胞死亡(Immunogenic cell death,ICD)在抗肿瘤免疫治疗中发挥着重要作用,它能将免疫抑制的“冷肿瘤”转化为免疫活化的“热肿瘤”。然而,目前开发的ICD诱导剂大多都是传统的化疗药,存在内质网靶向能力较低,释放DAMPs不足等问题,不足以触发足够强度的ICD效应。
研究表明,内质网-线粒体在物理和功能上的相互作用在调节免疫反应中具有重要的作用。首先,内质网是细胞内Ca2+储存的重要位置,在信号转导中起着至关重要的作用。在严重或长期的内质网功能紊乱下,内质网应激通过释放Ca2+并触发一系列信号转导通路触发细胞死亡。线粒体是调控体内氧化还原平衡的主要场所,氧自由基的产生速率远远超过清除速率,最终导致氧自由基的大量积累,从而诱发氧化应激。而线粒体相关膜(MAM)是细胞内活性氧ROS调节和钙离子(Ca2+)流动的枢纽。内质网应激触发Ca2+通过MAM从内质网释放到线粒体。相反,线粒体产生的活性氧ROS影响内质网,加剧内质网应激,促进Ca2+释放增加,进一步导致线粒体功能障碍和细胞凋亡或坏死。该级联效应可导致损伤相关分子模式(DAMPs)的释放,从而促进树突状细胞成熟,激活肿瘤反应性T细胞,并启动抗肿瘤免疫应答。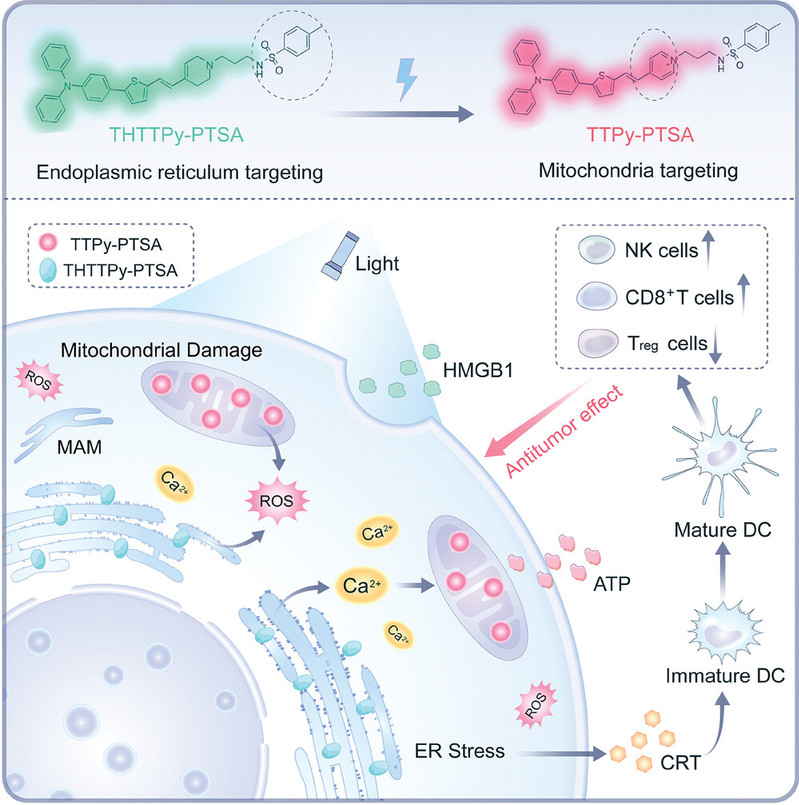
鉴于此,华南理工大学张云娇教授、高蒙副研究员和中山大学王兴武副教授开发了一种光激活的新型ICD诱导剂,名为THTTPy-PTSA,该分子以对甲苯磺酰胺(PTSA)作为内质网靶向基团,在光照射下,四氢吡啶基团发生光氧化脱氢反应,转化为靶向线粒体的吡啶基团,通过光控调节从内质网到线粒体的依次靶向,通过时空调控内质网-线粒体的网络调控作用触发级联放大的内质网应激反应。研究结果显示,光激活的THTTPy-PTSA能有效引发内质网应激与线粒体损伤,显著提升肿瘤细胞释放DAMPs的水平,并在动物疫苗模型中验证了该分子的体内抗肿瘤活性,为肿瘤免疫治疗提供了新思路。研究工作以“Photodynamic Modulation of Endoplasmic Reticulum and Mitochondria Network Boosted Cancer Immunotherapy”为题,发表在国际著名期刊Advanced Materials(Adv. Mater. 2023, 2310964)。论文的第一作者是华南理工大学医学院王晓荔硕士、钱洁颖博士后和杨振宇博士,通讯作者分别为张云娇教授、高蒙副研究员及中山大学王兴武副教授,华南理工大学医学院为论文的第一单位。
(1)具有优越内质网靶向能力的THTTPy-PTSA,光激活后可选择性靶向线粒体,触发内质网-线粒体互作网络,引起内质网应激与线粒体损伤并产生ROS,激活PERK介导的eIF2α磷酸化信号通路,引起Ca2+外流。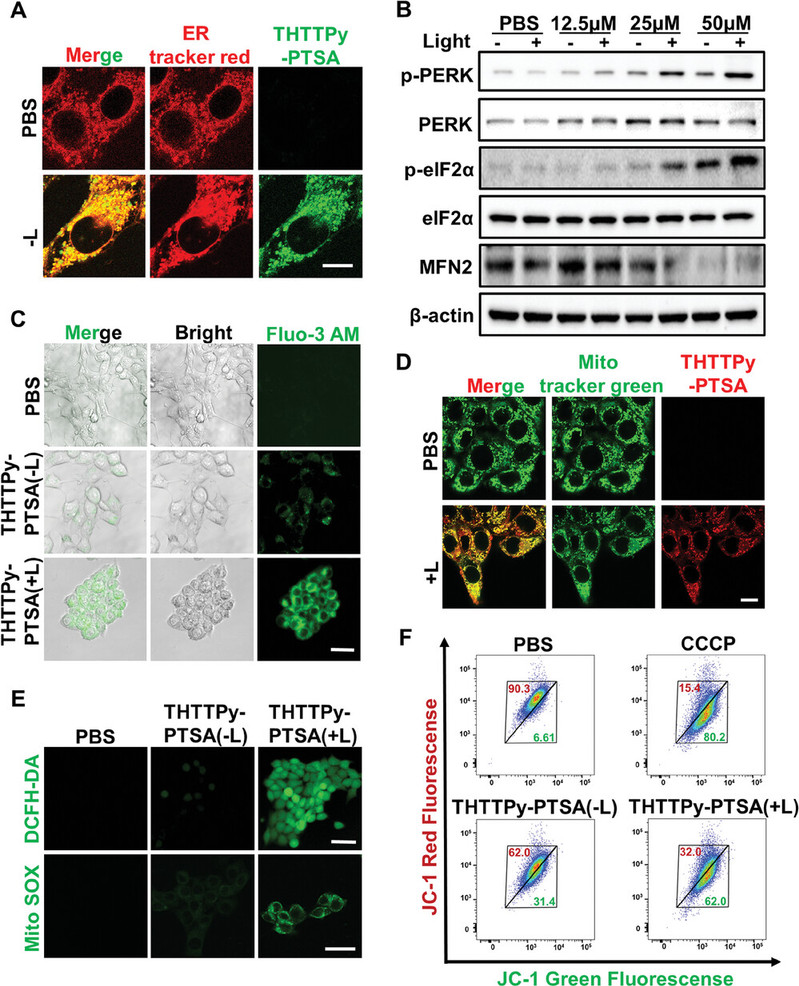
(2)光激活THTTPy-PTSA诱导内质网和线粒体的双重氧化应激可促进免疫原性细胞死亡,有利于增加DAMPs释放水平,促进树突状细胞成熟。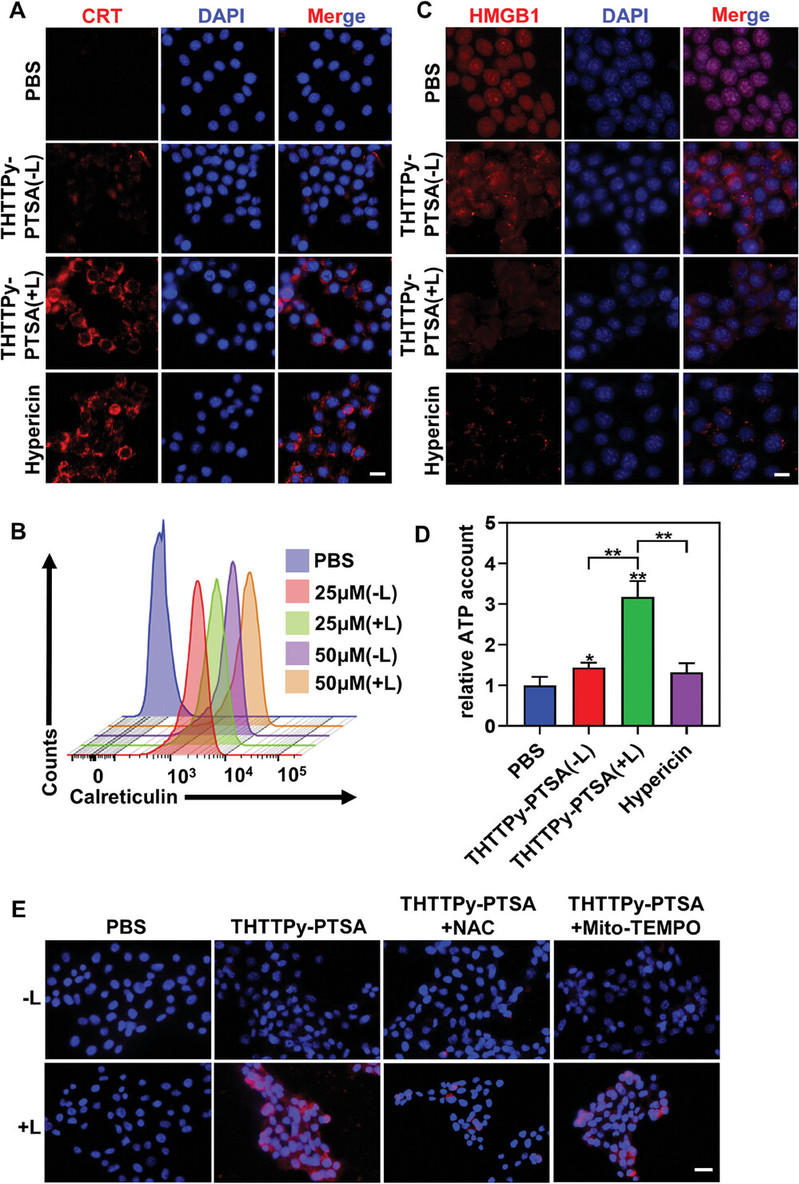
(3)体内实验结果表明,光激活THTTPy-PTSA有助于增强肿瘤微环境中CD8+ T细胞和NK细胞的浸润水平,同时抑制Treg细胞的表达,从而显著抑制肿瘤生长。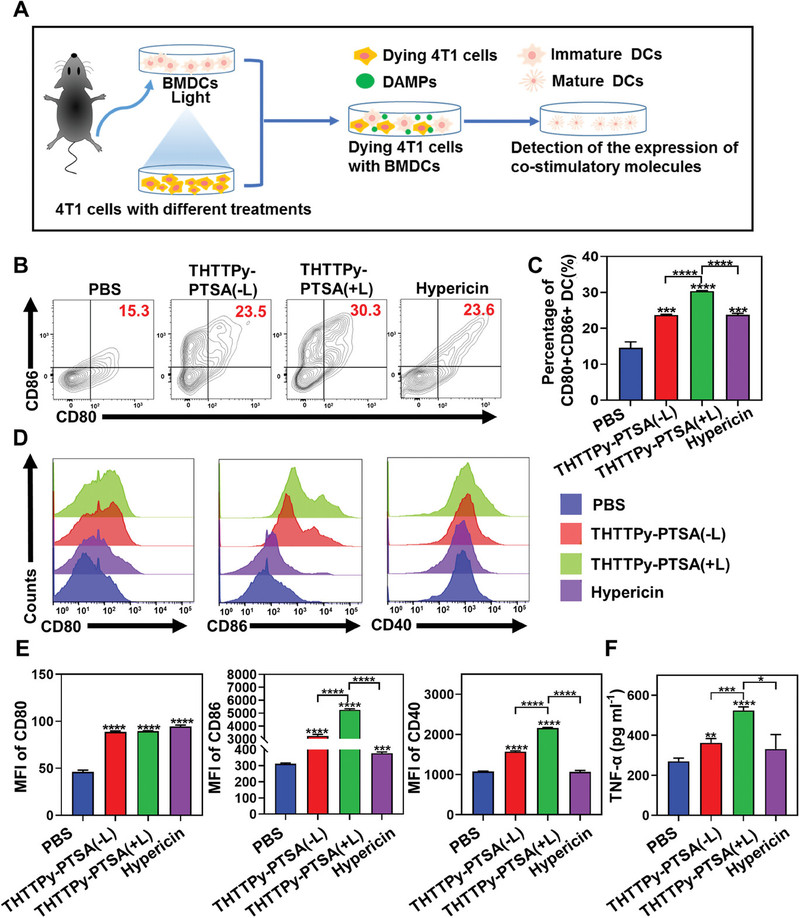
综上,该研究设计了一种光动力调控从内质网到线粒体依次靶向的ICD诱导剂,可以有效地增强抗肿瘤免疫反应,为新型ICD诱导剂的设计及肿瘤治疗提供了新思路。原文链接
https://onlinelibrary.wiley.com/doi/full/10.1002/adma.202310964





