肝癌是一种恶性程度极高的消化系统肿瘤,早诊难,一旦发病,进展迅速。目前放、化疗仍然是肝癌治疗的主要手段,但是预后极差且容易复发。免疫治疗是近年来备受瞩目的一类新兴肿瘤治疗策略,然而由于肝癌具有免疫抑制性微环境,肝癌患者对于适应性免疫治疗应答率低下,并且极易产生免疫治疗耐受。基于此,激活固有免疫信号通路有望提高肝癌的免疫细胞浸润和免疫治疗响应率,为肝癌免疫治疗提供新方向。
cGAS-STING信号通路作为固有免疫抗肿瘤机制的一个重要组成部分,其下游免疫细胞因子的释放可以增强肿瘤免疫微环境中效应性的免疫细胞活力。此外,cGAS-STING通路的激活可以大大提高抗原呈递细胞(APCs)的抗原提呈的效率。近年来多种STING激动剂已被广泛应用于免疫治疗研究中。然而,由于STING激动剂在血液中被快速清除或没有选择性而造成全身免疫的缺陷,使得其临床应用受到阻碍。此外,目前很多研究开发出通过肿瘤局部放疗、靶向性化疗或光动力手段促进受损线粒体和细胞核释放的内源性dsDNA来激活肿瘤局部cGAS-STING信号通路的策略,但由于细胞自噬等保护机制的存在,这种内源性激活免疫效应的方式具有一定限制。因此,开发有效的、可避开癌细胞保护机制的持续破坏线粒体/细胞核的靶向化合物是一种具有前景的策略。
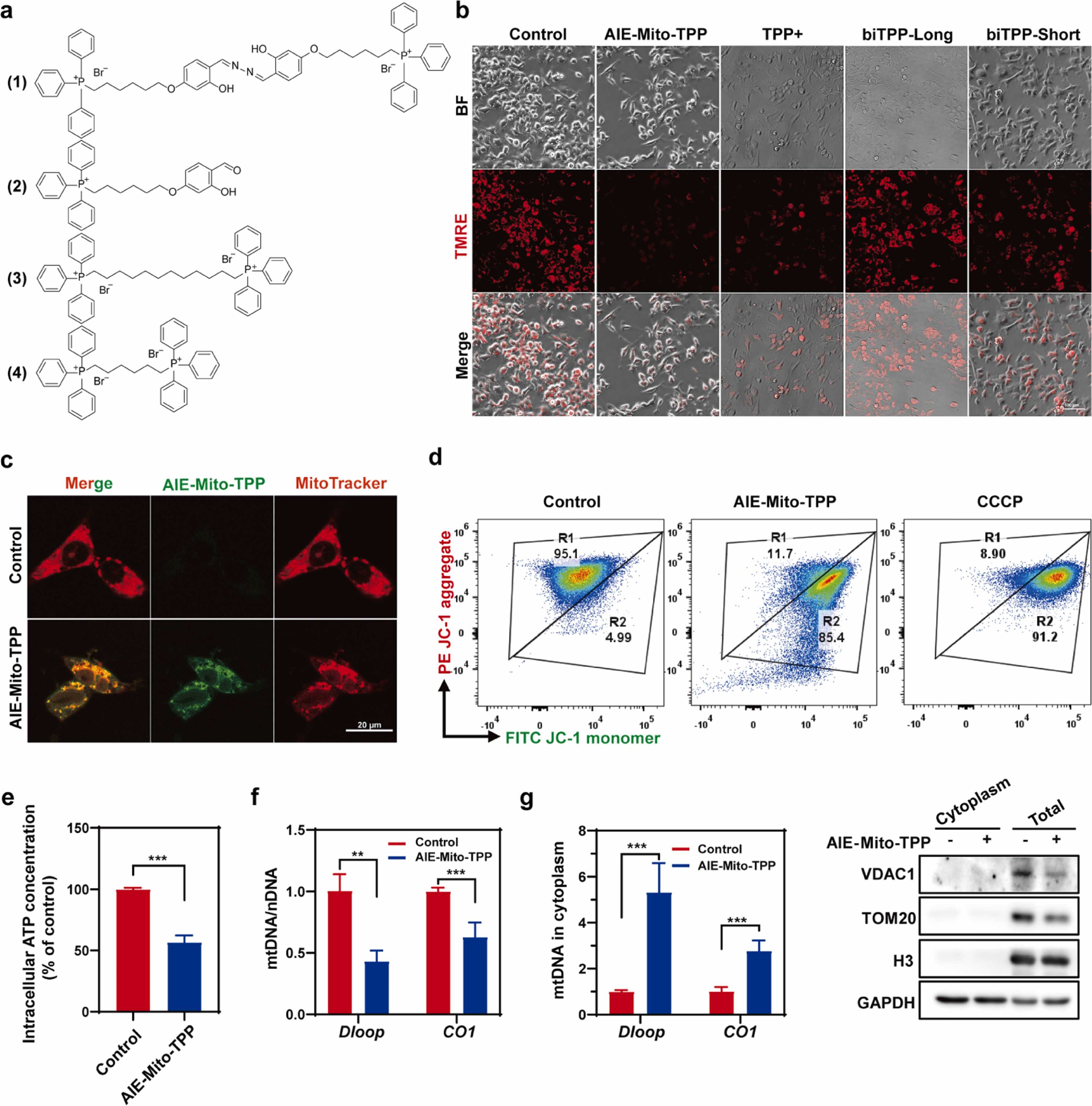
鉴于此,华南理工大学张云娇教授团队合成并筛选出靶向并破坏线粒体的三苯基膦基化合物——AIE-Mito-TPP。该分子可显著造成肝癌细胞线粒体膜电位改变、ATP水平降低并造成大量mtDNA持续释放。研究团队首次证明了AIE-Mito-TPP触发了不完整线粒体自噬,加重了线粒体损伤和mtDNA的释放,进而持续激活cGAS-STING通路,重塑肿瘤免疫微环境、显著增强抗肿瘤免疫反应,为肿瘤免疫治疗提供了新思路。

本文要点:
(1)具有优越线粒体靶向能力的AIE-Mito-TPP通过破坏线粒体,释放大量mtDNA,有效激活肝癌细胞cGAS-STING通路并诱导其下游细胞因子释放。
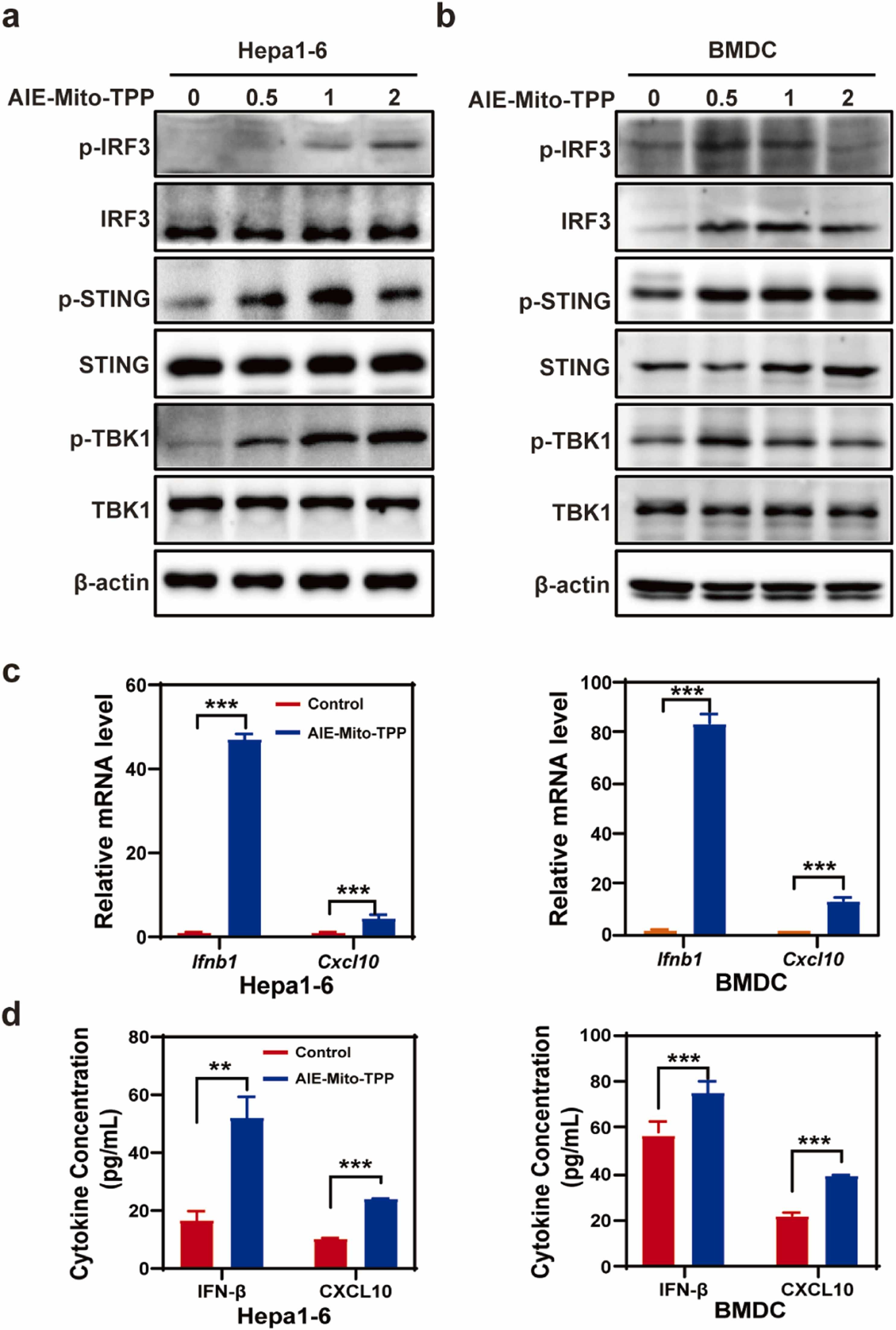
(2)AIE-Mito-TPP激活Hepa1-6细胞以及树突状细胞中cGAS-STING信号通路,并促进下游因子表达与分泌。
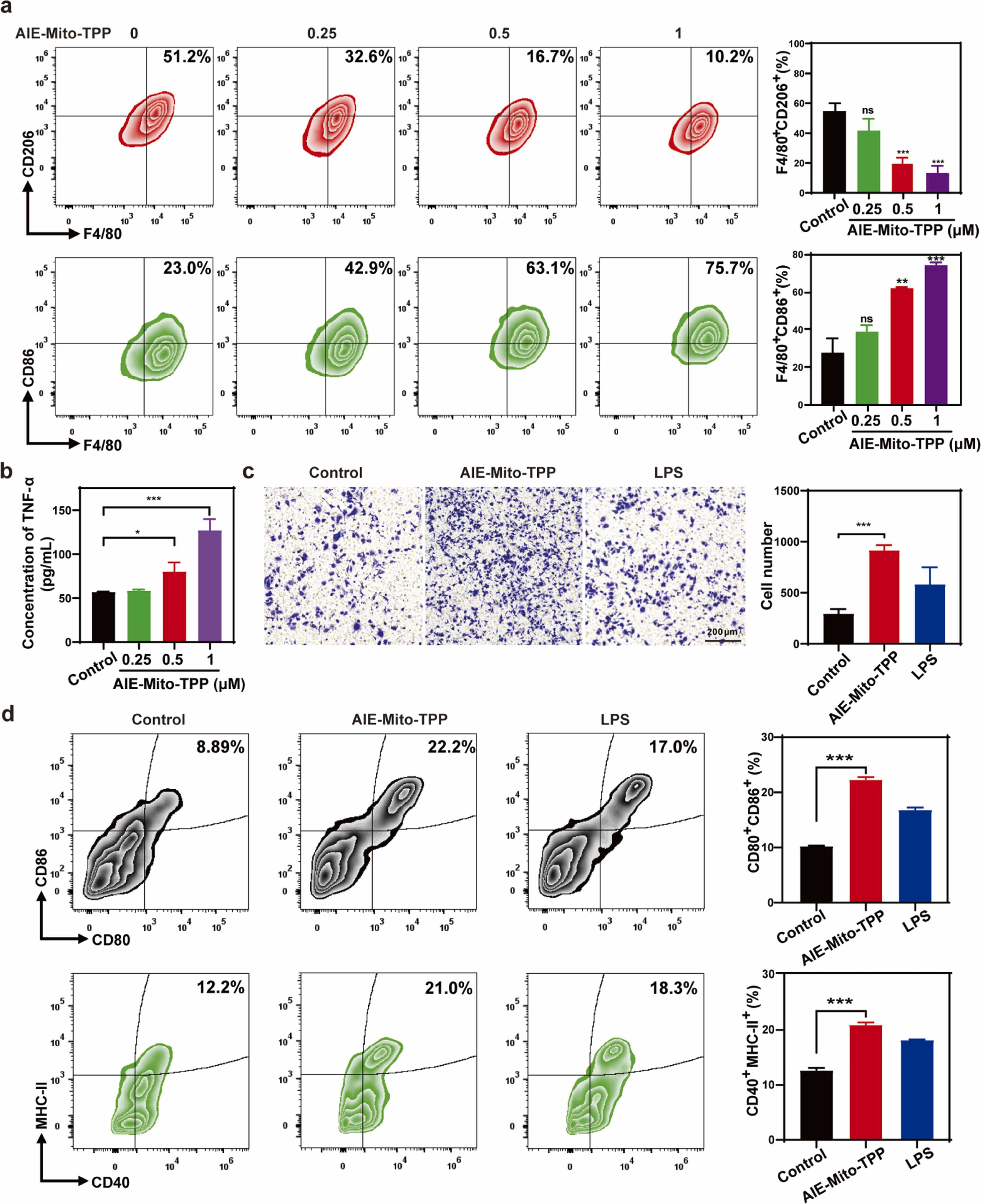
(3)AIE-Mito-TPP极化肿瘤相关巨噬细胞,并且诱导肝癌细胞中抗原的释放,促进树突状细胞成熟。
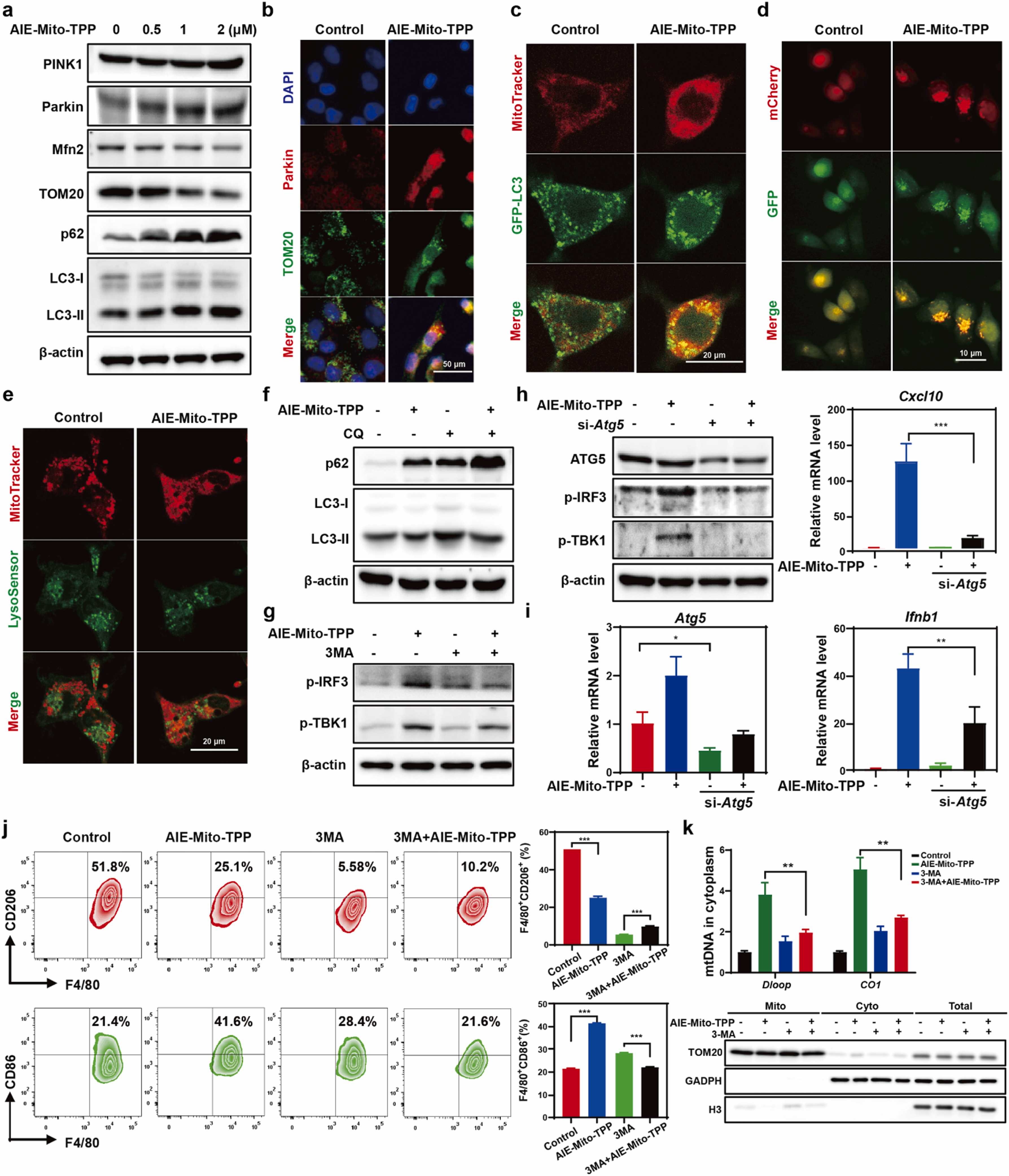
(4)AIE-Mito-TPP触发了不完整线粒体自噬,加重了线粒体损伤和mtDNA的释放,进而持续激活cGAS-STING通路,显著增强抗肿瘤免疫反应。
(5)为优化AIE-Mito-TPP体内递送、降低其毒副作用以及增强免疫治疗效果,本研究设计了DPPA-1 M@AIE-Mito-TPP纳米递送系统,主要利用马来酰亚胺(Mal)-PEG-PLGA对AIE-Mito-TPP进行封装,并在外层修饰基质金属蛋白酶2/9(MMP2/9)响应释放、抑制PD-L1免疫检查点的串联多肽(DPPA-1 M)。体内实验结果表明,DPPA-1 M@AIE-Mito-TPP纳米颗粒能够重编程肝脏肿瘤免疫微环境,即极化肿瘤相关巨噬细胞、增强T细胞浸润及活化、减少免疫抑制性细胞MDSC和Treg,并明显促进肝癌的原位消退,显著延长荷瘤小鼠的生存期。
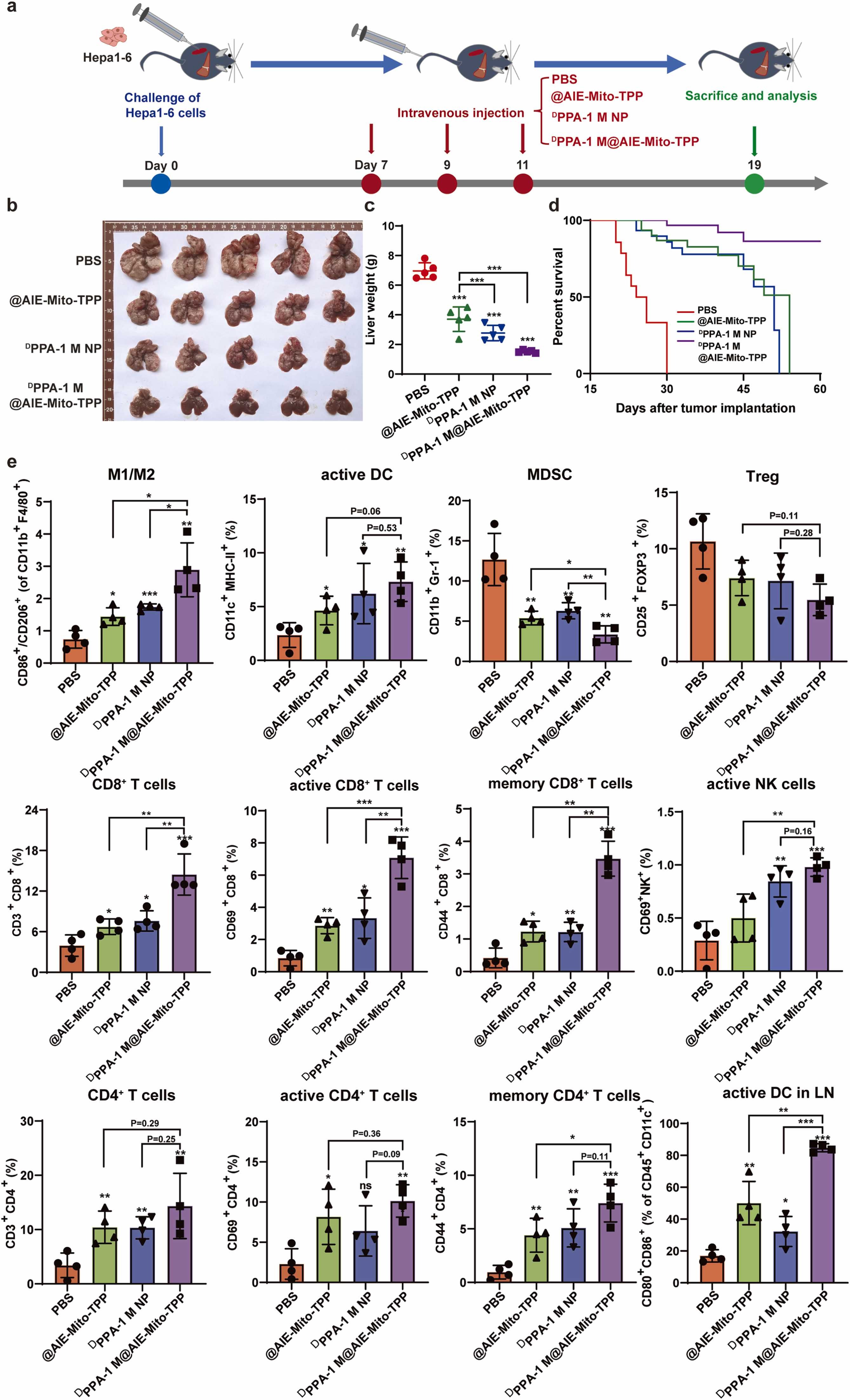
综上,本研究提出了一种新的靶向线粒体激活免疫的治疗策略,通过诱导不完整线粒体自噬以持续不断地释放mtDNA来刺激肝癌的固有免疫,并揭示了AIE-Mito-TPP在肿瘤免疫治疗中的潜力。本研究开发的DPPA-1 M@AIE-Mito-TPP纳米递送系统提高了AIE-Mito-TPP免疫治疗的有效性和安全性,为未来的临床治疗及应用提供重要的参考价值。
本工作以“Harnessing a triphenylphosphine-based AIE nano-platform for triggering incomplete mitophagy to continuously augment anti-tumor immune response in hepatocellular carcinoma”为题,发表在国际著名期刊《Nano Today》上。论文的第一作者是华南理工大学宋洋博士和杨振宇博士,通讯作者分别为张云娇教授与钱洁颖博士后,华南理工大学为论文的第一单位。
