研究简介
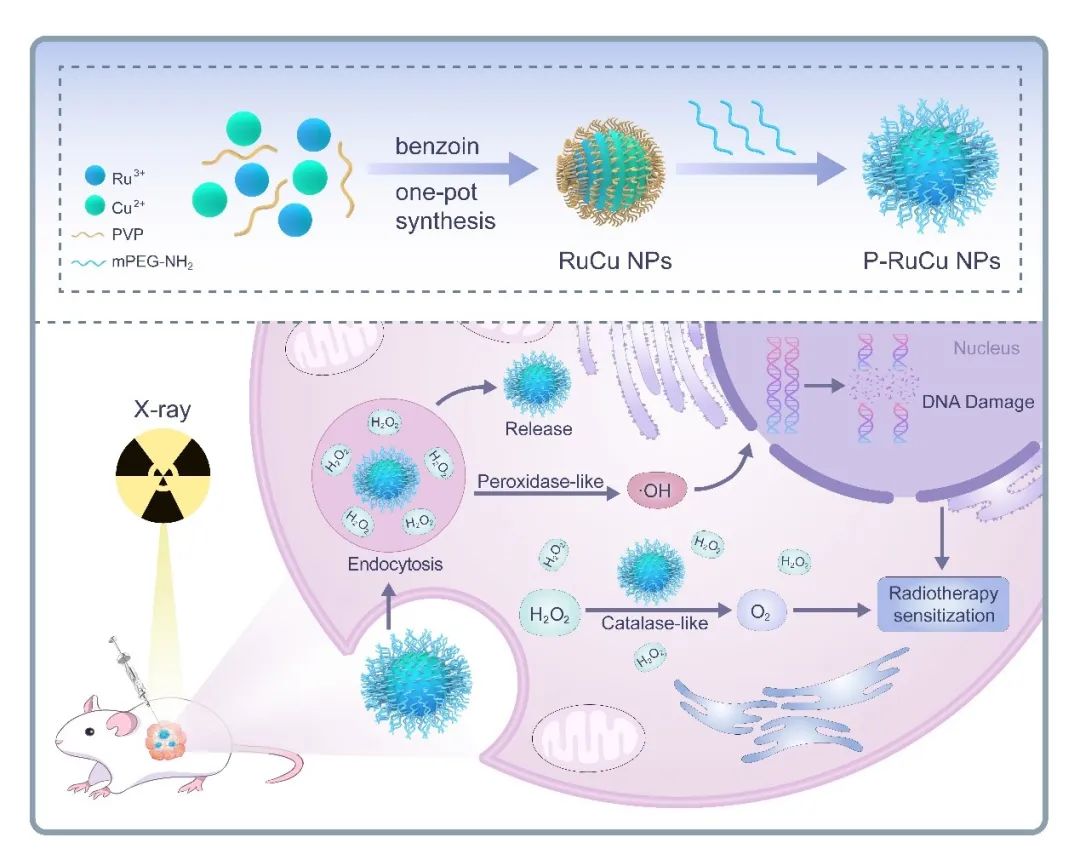
图1. 钌铜纳米颗粒(P-RuCu)的合成过程以及利用P-RuCu的纳米酶效应增强对肿瘤治疗作用的示意图
放射治疗(RT)是目前临床上常用的治疗癌症的方法,但其疗效受限于辐射能量的限制,容易对正常组织造成副作用。肿瘤的乏氧微环境引起的放疗抵抗也是临床治疗失败的原因之一。因此,开发高效、低毒的新型放疗增敏剂,对克服放疗抵抗具有重要意义。研究表明,利用纳米酶与肿瘤微环境相互作用实现肿瘤协同治疗,是提高放疗疗效和安全性的有效策略。
为此,华南理工大学张云娇教授和中山大学孙逸仙纪念医院潘越研究员构建了一种双金属纳米颗粒(RuCu NPs)作为新型的放疗增敏剂。其中,含有高原子序数(Z)元素Ru能够吸收X射线产生活性氧(ROS)实现放疗增敏作用;另外,这种双金属纳米颗粒具有双酶活性:类过氧化物酶 (POD-like) 活性和类过氧化氢酶(CAT-like)活性。一方面其能够与肿瘤微环境相互作用产生羟基自由基增强肿瘤治疗效果,另一方面产生氧气改善乏氧,有效逆转放疗抵抗。最终实现纳米颗粒与放疗协同治疗效果。基于“天河二号”超级计算机,作者通过密度泛函理论(DFT)阐明了RuCu NPs材料在不同Cu掺杂比例下的类过氧化物酶催化反应机制,确定了RuCu NPs催化过氧化氢生成羟基自由基能力最优时,Cu的掺杂比例,并且模拟结果与实验一致。在 X 射线照射下,聚乙二醇 (PEG) 修饰的 RuCu NPs (P-RuCu)在肿瘤微环境中能同时催化过表达的H2O2产生ROS,发挥其类过氧化物酶效应,对肿瘤细胞起到杀伤作用;以及催化H2O2产生氧气,缓解肿瘤缺氧,发挥其类过氧化氢酶效应,并在 MDA-MB-231乳腺癌模型中表现出显著的治疗效果。这项工作为放疗增敏策略提供了概念验证,该策略结合了高 Z 元素的内在性质和纳米酶的优点,克服了放疗中存在的棘手问题,进一步为探索基于纳米酶的肿瘤催化治疗和协同放疗策略开辟了新方向。
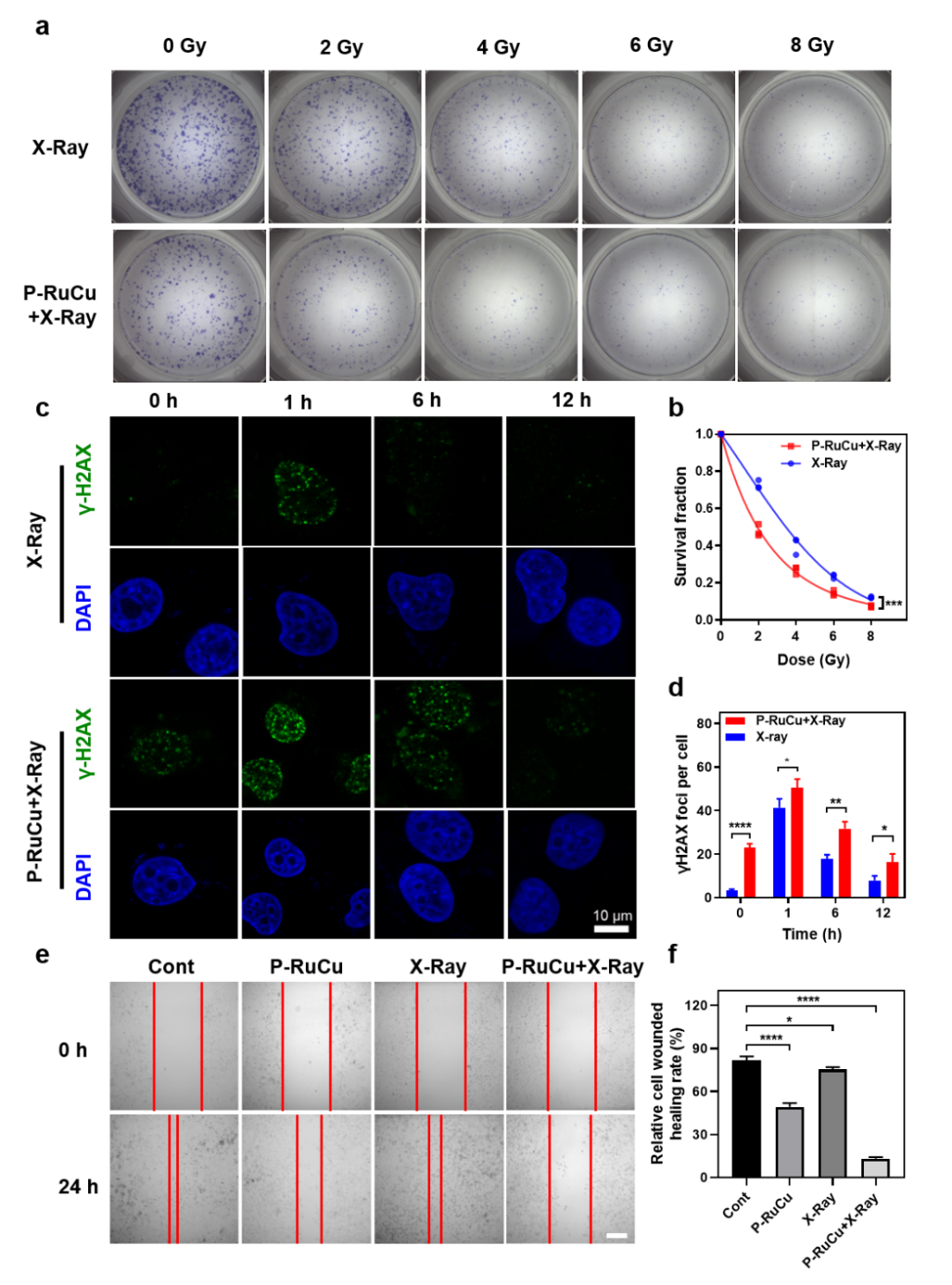
图2. P-RuCu通过 DNA 损伤增强肿瘤细胞死亡。(a) 在 0、2、4、6 和 8 Gy 的不同辐照剂量下,用P-RuCu治疗的MDA-MB-231细胞的克隆形成图像。(b)使用 P-RuCu (5 μg mL-1) 和不同剂量的 X 射线联合治疗后,MDA-MB-231细胞的存活曲线。(c)γ-H2AX 和 DAPI染色后MDA-MB-231细胞的共聚焦荧光图像。细胞用 PBS 或 P-RuCu (5 μg mL-1) 处理,并在 X 射线(4 Gy)照射 0、1、6、12 小时后染色。(d)MDA-MB-231细胞中γ-H2AX病灶密度的定量分析。(e-f) MDA-MB-231 细胞在不同方法处理 24 小时后的细胞迁移图像(e)和相应的统计数据(f)。

图3. P-RuCu增强MDA-MB-231小鼠乳腺癌模型中的放射治疗效果。(a,b)在不同治疗方案下, 荷瘤裸鼠(每组 n = 6)在12 天的治疗周期内的体重变化(a)和相对肿瘤体积(b)的变化。(c) 第12天切除的肿瘤图像。(d) 第12天时,不同治疗组内小鼠的肿瘤重量。(e)肿瘤组织的 TUNEL 和H&E 染色显微图像。
论文第一作者为华南理工大学硕士胡伯川和中山大学孙逸仙纪念医院肖晓慧博士以及中山大学计算机学院陈品博士。华南理工大学张云娇教授和中山大学孙逸仙纪念医院潘越研究员为该文章的通讯作者。
