p53是迄今发现与人类肿瘤相关性最高的基因。据统计,超过50%的人类癌症中都观察到了TP53基因的突变,其中大多数是错义突变,并在细胞中产生了稳定的突变p53蛋白。突变p53蛋白往往在肿瘤细胞中高水平表达,难以降解,不仅丧失了抑癌功能,还常常产生新的功能,促进癌症的发生发展。靶向突变p53蛋白降解是针对p53突变癌症的一种可行的治疗策略,但是目前主要依靠小分子的方法还远远不够。
2021年2月14日,华南理工大学温龙平/张云娇教授团队在《Biomaterials》杂志发表了题目为“Glutathionylation-dependent proteasomal degradation of wide-spectrum mutant p53 proteins by engineered zeolitic imidazolate framework-8”的研究论文。

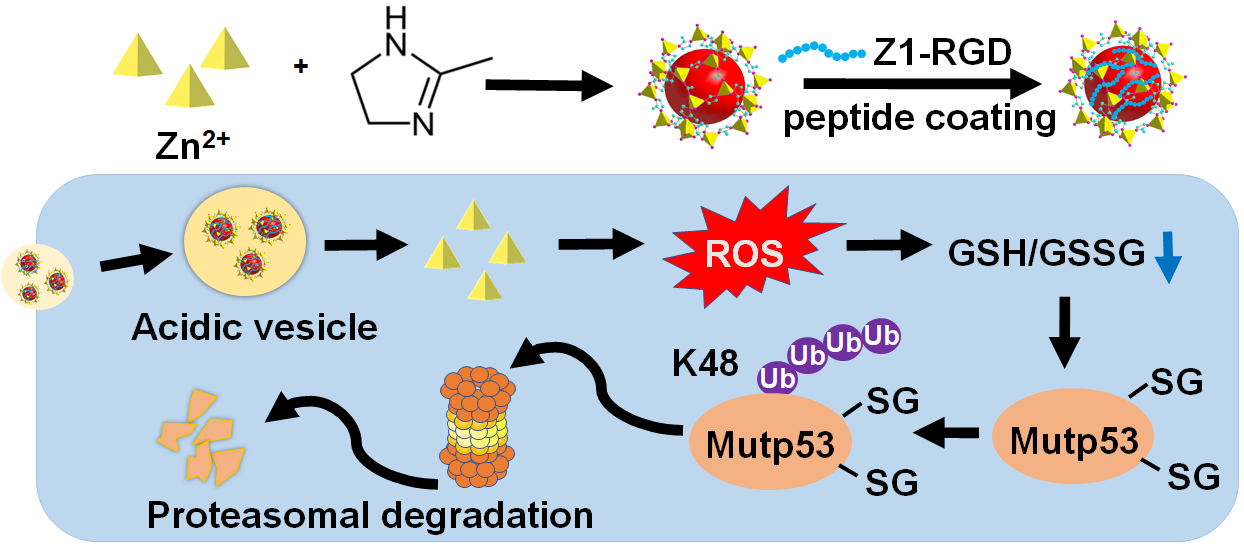
研究人员开发了一种新的策略来调控突变型p53蛋白的稳定性。研究结果显示pH响应性的沸石咪唑酯骨架-8(ZIF-8)纳米颗粒可以通过谷胱甘肽化依赖的泛素-蛋白酶体途径降解突变p53蛋白。内吞进入细胞的ZIF-8在酸性内体中分解释放Zn2+,降低了细胞内还原型谷胱甘肽(GSH)和氧化型谷胱甘肽(GSSG)的比例,从而促使突变p53蛋白发生谷胱甘肽化,进而通过泛素介导的蛋白酶体途径降解。Z1-RGD短肽工程化修饰后的纳米颗粒(P-ZIF-8)增强了对肿瘤细胞的靶向能力,降低了对正常细胞的毒副作用,增强了表达突变p53的肿瘤细胞的降解效果,并在ES-2卵巢癌模型以及患者衍生的异种移植(PDX)乳腺癌模型中显示出显著的治疗功效。
该项研究显示ZIF-8除了作为一种有前途的药物载体外,还具有诱导广谱突变型p53蛋白降解的能力,并且短肽工程化修饰后有效提高了ZIF-8纳米颗粒的安全性和有效性,为以后靶向突变p53肿瘤治疗的药物研发和药物设计提供了新思路新方法。