
目前,全球估计有1100万癌症患者存在TP53基因的错义突变,并表达高度稳定的突变型p53。p53 作为最重要的抑癌基因之一,与癌症的发生发展密切相关。研究表明,超过50%的人类肿瘤中都观察到TP53 基因的突变。突变型p53 蛋白往往在癌细胞中高水平表达,难以降解,不仅丧失了抑癌能力,还常常产生新的促进癌症发生发展的功能(Gain-of-function),如导致基因组的不稳定,促进肿瘤的发展、恶化、转移,抗凋亡,耐药等。肿瘤高发p53 突变是癌症治疗面临的巨大难题。
针对这一难题,华南理工大学温龙平/张云娇教授团队采用具有独特生物活性的工程化纳米材料策略来调控突变型p53的稳定性。通过优化锌和铁的比例,研发出一种锌铁比例为1比2的锌掺杂氧化铁纳米颗粒,能够在肿瘤细胞内酸性溶酶体中释放锌离子,介导蛋白酶体依赖的突变型p53蛋白降解作用,逆转突变p53的获得性功能,诱导肿瘤细胞的死亡。研究结果显示,锌铁纳米粒能显著提高突变p53肿瘤细胞对化疗药物的敏感性,并在人卵巢癌以及病人来源的乳腺癌等突变p53肿瘤模型验证了抗肿瘤活性,为实现突变p53肿瘤的诊疗一体提供新思路新方法。
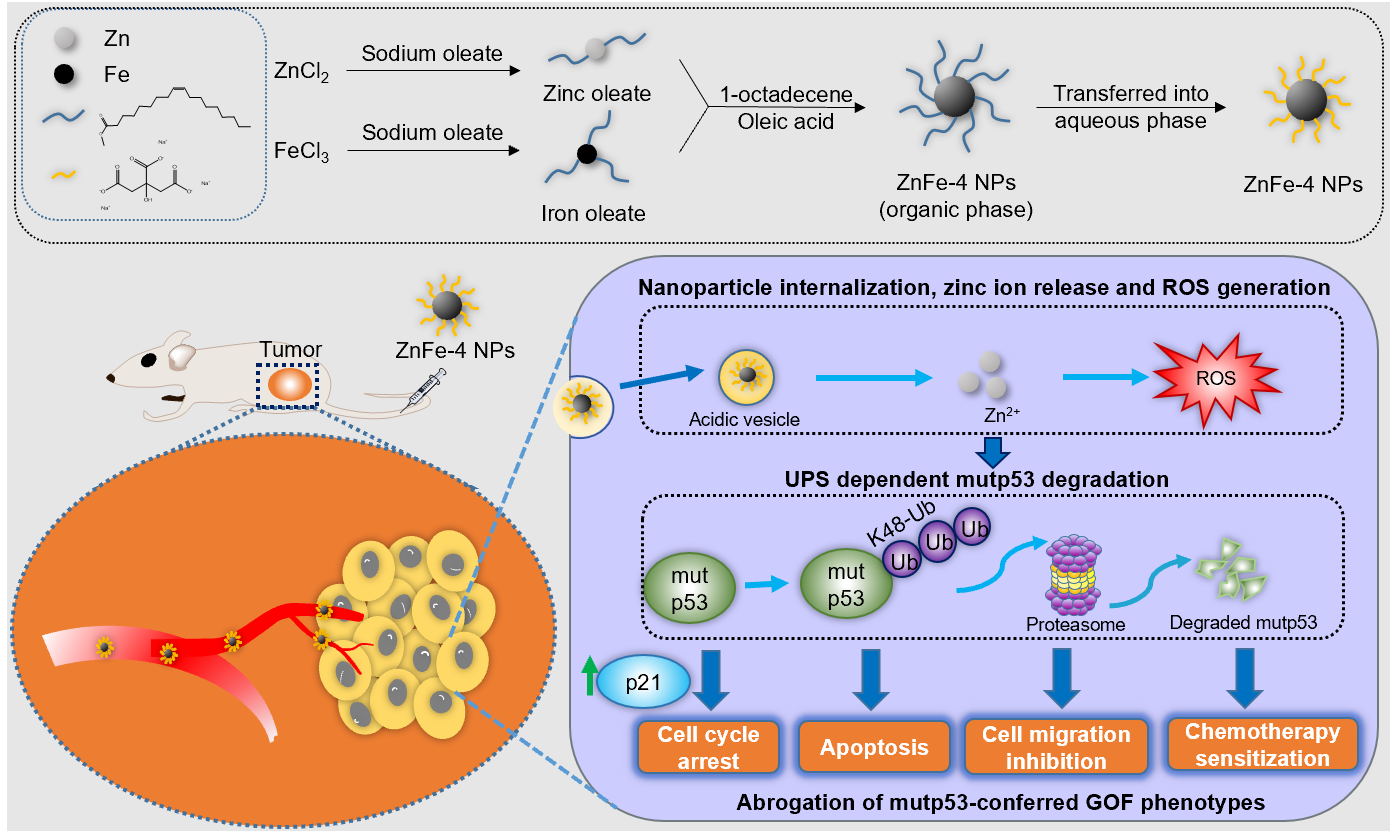
研究工作简介
本文要点
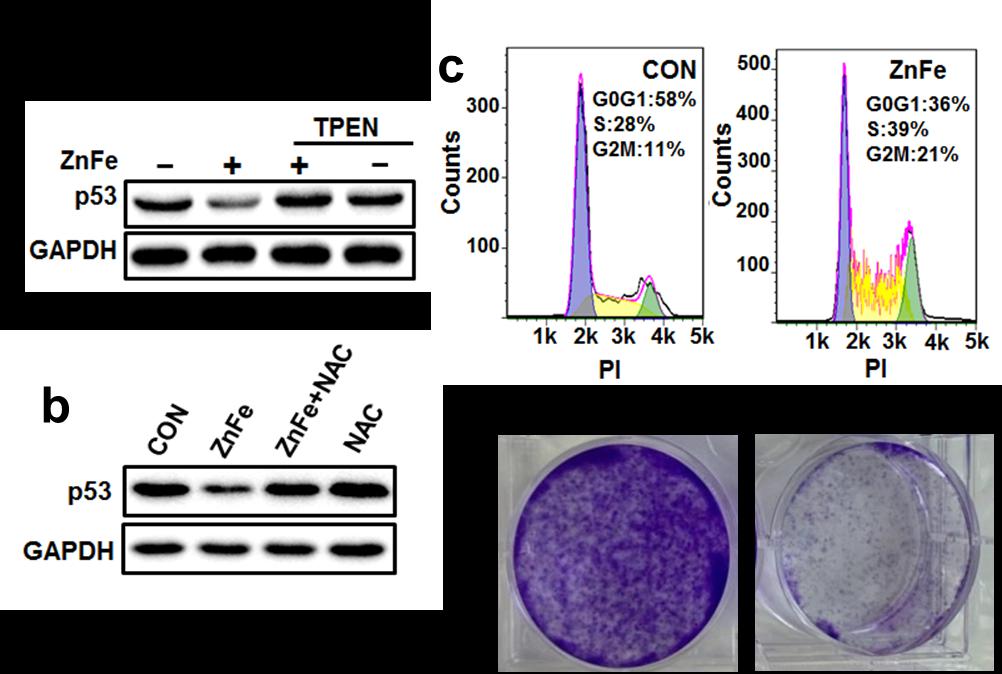
1)通过合成不同比例的锌掺杂铁纳米粒,发现Zn和Fe的比例为1:2时,可以有效降解肿瘤细胞中的突变型p53。这种兼具MRI成像功能的锌铁纳米材料可诱导构象型以及DNA结合型突变p53通过泛素-蛋白酶体途径降解,并呈时间和剂量依赖性,但并不降解野生型p53。这说明锌铁纳米材料调控p53的特异性。锌铁纳米材料这种同时兼具突变型p53降解和MRI造影能力的优势,为实现突变p53肿瘤的诊断和治疗提供了重大机遇。
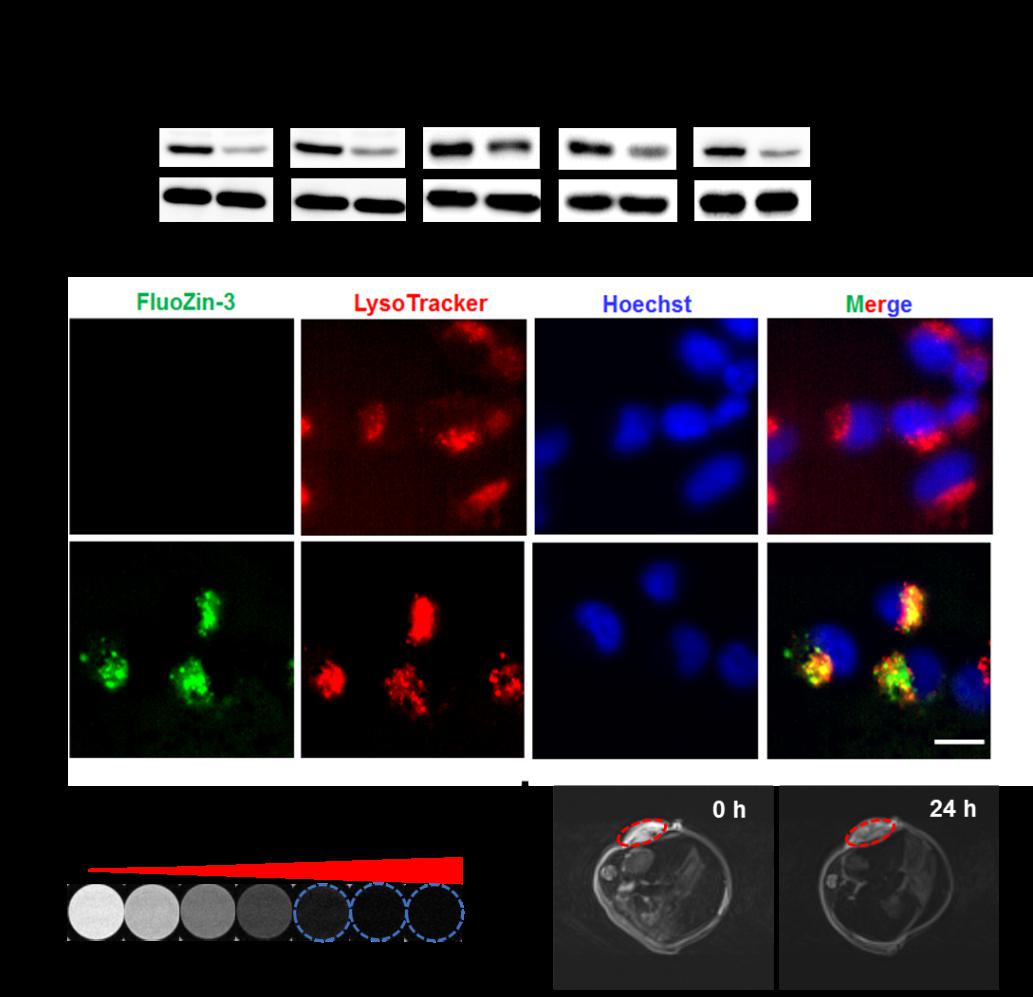
2)锌铁纳米材料通过内吞作用进入肿瘤细胞,释放锌离子以及引起细胞内活性氧升高是降解突变型p53的关键因素。锌铁纳米材料通过降解了肿瘤细胞中的突变型p53 后,解除了突变p53的获得性功能,包括抑制了细胞周期、增殖、迁移以及耐药等,从而诱导癌细胞的死亡。
3) 锌铁纳米材料能显著提高顺铂在ES-2(表达S241F突变型p53的人卵巢癌细胞)皮下肿瘤模型中的治疗效果,同时在PDX乳腺癌(表达Y220C突变型p53)模型中,显著抑制肿瘤的生长,锌铁纳米材料特异性杀伤突变p53肿瘤细胞,同时显著增强了突变p53肿瘤细胞对化疗药物的敏感性,实现了突变p53肿瘤的高效精准治疗。进一步证明了锌铁纳米材料的潜在临床应用价值。
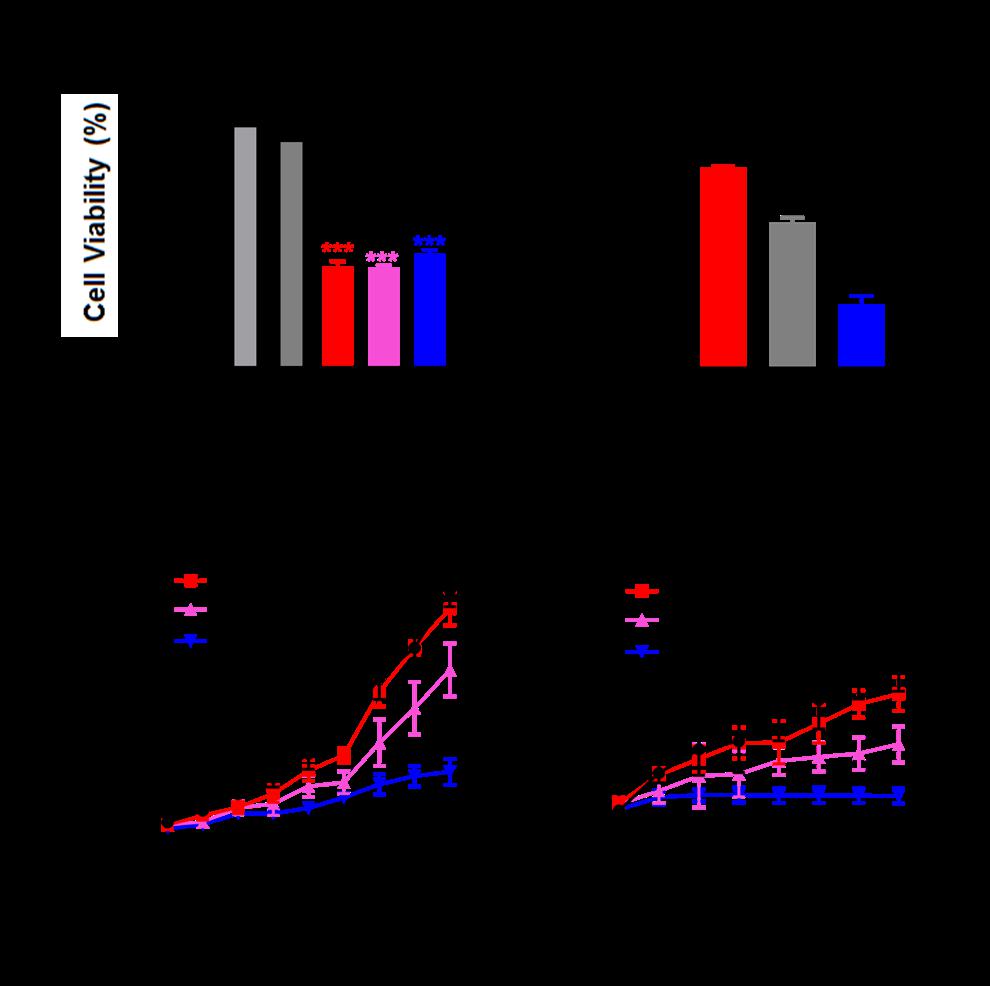
综上所述,锌铁纳米材料具有卓越的降解突变p53的能力,同时对于正常细胞的毒性较小,具有其他含锌化合物无法比拟的优势,这启发我们锌铁纳米材料可作为一种潜在的化疗增敏剂,在治疗突变p53肿瘤中协同化疗药物发挥良好的治疗作用,有效提高了对肿瘤的治疗,为以后靶向突变p53肿瘤治疗的药物研发和药物设计提供新思路新方法。
本工作以“Enhancing Chemotherapy of p53-Mutated Cancer through Ubiquitination-Dependent Proteasomal Degradation of Mutant p53 Proteins by Engineered ZnFe-4 Nanoparticles”为题,发表在国际著名期刊Advanced Functional Materials(Adv. Funct. Mater. 2020, 2001994)。论文的第一作者是华南理工大学医学院(生命科学研究院)钱洁颖博士、张文彬硕士和魏鹏飞博士后,通讯作者分别为张云娇教授、温龙平教授及南方医院姚广裕教授,华南理工大学为论文的第一单位。
