水凝胶薄膜发Nature!两位院士力作,耗时近3年终发表

【研究摘要】
连接不同的电子设备通常很简单,因为它们配有成对的标准化接口,这些接口的形状和大小能够完美匹配。然而,组织-电子接口却无法标准化,因为组织是柔软的,具有任意的形状和大小。尽管通过使用热收缩薄膜,已经实现了对不规则大小和形状物体的形状自适应包裹和覆盖,因为这些材料在加热时可以大幅且快速地收缩。然而,这些材料不适合生物应用,因为它们通常比组织硬得多,且需要在高于90°C的温度下收缩。因此,对于与生物组织紧密贴合的电子设备而言,仍需要一种更为灵活、温和的材料。
因此,制备一种能与脆弱组织和电子集成过程兼容的、具有大且快速收缩特性的刺激响应性薄膜是一项挑战。在这项研究中,受到蜘蛛丝的启发,新加坡南洋理工大学的陈晓东院士、高华建院士团队联合南京医科大学的胡本慧教授、中国科学院大学刘志远研究员团队,设计了一种水响应性超收缩聚合物薄膜,它由聚环氧乙烷和聚乙二醇-α-环糊精包合物组成。这种薄膜最初是干燥的、柔软的且在环境条件下是稳定的。湿润后,薄膜在数秒内能收缩到原来长度的50%以上(大约每秒收缩30%),然后变得柔软(大约100 kPa)和可拉伸(约600%),最终变为水凝胶薄膜。这种超收缩性能归因于薄膜的排列微孔层级结构,这也促进了电子集成。研究团队利用这种薄膜制造了形状自适应电极阵列,通过超收缩简化了植入过程,并在湿润时,可适应性地包裹不同大小的神经、肌肉和心脏,以用于体内神经刺激和电生理信号记录。本研究表明,这种水响应性材料在塑造下一代组织-电子接口以及扩大形状自适应材料的生物医学应用方面可发挥重要作用。
文章以《Water-responsive supercontractile polymer films for bioelectronic interfaces》为题发表在Nature上。

【研究背景】
近年来,形状包裹生物电子设备的研究日益受到科研界的瞩目,这主要得益于软弹性体和形状记忆材料的卓越性能。这些材料能够与生物组织实现良好的界面结合,且无需额外的缝合固定步骤,即可在动态环境下展现出优异的适应性。然而,这类设备的尺寸和形状需事先根据目标器官的特性进行定制,以确保其能够精准匹配并发挥功效。在众多潜在的解决方案中,由刚性热收缩聚合物制成的收缩性形状自适应包裹展现出了巨大的应用前景。然而,将这种包裹植入生物体内并非易事,它要求材料既要柔软可拉伸,又能在环境条件下保持稳定。更为关键的是,这些材料需要在与软组织相兼容的刺激下,实现大幅(超过50%)且迅速的(数秒内)收缩,以满足实际应用的需求。通过对材料性能的精准调控和不断优化,我们有望为生物电子设备的形状包裹提供更为理想、高效的解决方案,从而推动这一领域的研究和应用取得更为显著的进展。
目前报道的生物与合成材料在多种刺激下展现出了快速收缩的特性。然而,高温、紫外线和酸性溶液等刺激条件与生理环境的脆弱性不相容,限制了它们在生物领域的应用。相比之下,体温(37°C)作为一种温和且适宜的刺激条件,引起了广泛关注。然而,现有的体温敏感材料往往存在收缩缓慢或在室温下不稳定的问题,这限制了它们在生物应用中的实用性。水作为一种良性刺激,在自然界中展现出了独特的魅力。例如,蜘蛛丝具有非晶定向聚合物链的分层结构,能够表现出独特的水致收缩现象,即超收缩。这种超收缩现象是由水可破坏的氢键和稳定的β片晶体交联的畴共同作用的结果。然而,制备合成超收缩材料仍然面临挑战,因为过于密集的氢键会阻碍超收缩的发生,而稀疏的氢键则在环境湿度下难以保持稳定。近年来,超分子聚合物、聚合物复合材料、重构角化蛋白和嵌段共聚物等材料被尝试用于制造收缩纤维。然而,这些材料在环境湿度下(如相对湿度为60%)往往表现出不稳定性,且它们的硬度与蜘蛛丝相似,对于软组织应用来说过于坚硬。此外,这些材料与二维平面制造工艺的兼容性也存在问题。相比之下,含水量大、柔软度如组织的水凝胶被认为与组织更相容。然而,由于水合层的存在以及不同材料之间表面能的差异,水凝胶与其他电子材料(如电子导电金属层和疏水绝缘层)的结合仍然是一个具有挑战性的问题。因此,在探索水凝胶在生物电子领域的应用时,需要克服这些界面结合方面的难题。

【研究内容】
在此,研究人员介绍了一种新型的水响应型自适应聚合物(WRAP)薄膜,它具备干燥、灵活且独立的特点。这种薄膜在常规环境条件下能够保持稳定,但一旦接触湿气,便能迅速并显著地收缩,进而转化为柔软且可拉伸的水凝胶薄膜。这种薄膜与软组织以及平面电子制造工艺均具有良好的兼容性。为了制备WRAP薄膜,研究人员巧妙地结合了聚乙二醇(PEG)与α-环糊精(α-CD)形成的包合物晶体域,以及水溶性半晶聚环氧乙烷(PEO)结构域。具体而言,他们首先将PEO与基于主-客体超分子相互作用形成的包合物凝胶进行混合,制备出了独立的包合物/聚环氧乙烷(IC/PEO)薄膜。接着,在电场作用下对IC/PEO薄膜进行反复冷拔,直至达到预定的应力水平。通过这种创新的方法,研究人员成功制备出了伸长率高达218%至700%的WRAP薄膜。这种薄膜不仅具备出色的物理性能,还展现出了良好的生物相容性和电子制造工艺兼容性,为未来的医疗和电子设备应用开辟了新的可能性。
【图文解析】
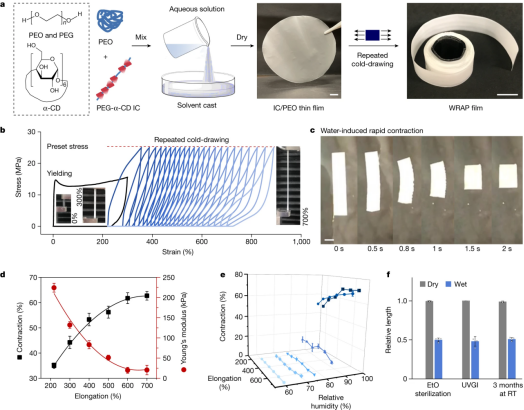
WRAP薄膜与超收缩。a、WRAP胶片批量生产过程的示意图和照片。b、通过反复冷拔制备WRAP薄膜。首先,我们将IC/PEO冷拔至300%应变,以获得电场后膜(黑色曲线)。然后我们将后场IC/PEO薄膜重复冷拔至预设应力25 MPa(根据后场薄膜的宽度和厚度计算),得到WRAP薄膜。插图,IC/PEO薄膜(左)在冷拔过程中经历了屈服和缩颈,导致白色的后场膜(中)进一步拉伸到700%伸长率(右)。c、WRAP薄膜的快速水致超收缩。WRAP薄膜受潮后2秒内收缩约60%。d,随着延伸率从218%增加到700%,WRAP薄膜的收缩性(黑色曲线)和柔软性(红色曲线)都有所增加。样品在水中浸泡1分钟后测量。e、湿度响应试验表明,伸长率为218% ~ 700%的WRAP薄膜在相对湿度小于80%时几乎没有收缩。在相对湿度为84%时开始部分收缩,而在相对湿度为94%和97%时发生大收缩。所有样品在固定相对湿度的密闭室中孵育24小时后进行测试。f, WRAP薄膜在EtO灭菌、紫外线杀菌(UVGI)和室温(RT)保存3个月后仍保持其超收缩反应。比例尺,1 cm (a,左),5 mm (a,右);3 mm (c)。d、e和f中的数据以平均值±s.d表示。从三到四个样本。

WRAP薄膜的微观结构及超收缩机理。a, SEM图像显示IC/PEO薄膜具有致密的表面,上面有堆积的血小板(白色箭头)。b, WRAP-400%的SEM图像显示了一个粗糙的微孔表面,有排列的纤维桥(插图)。冷拔方向为水平方向。c,链取向(二向色比)由极化FT-IR光谱测量。在1342 cm−1(平行带)和1281 cm−1(垂直带)处,PEO波段的二色比分别随着伸长而增大和减小。α-CD波段(1638 cm−1)接近1,保持不变。d、2D-WAXS模式显示WRAP-400%具有各向异性。PEO晶体的模式是各向异性的,而包合物的模式是各向同性的。e,扫描电镜和透射电子显微镜(TEM)(插图)图像的包涵复杂的血小板。f,g,水溶液中IC/ PEO、PEO/PEO和α-CD/PEO相互作用的分子动力学模拟。快照显示,PEO(49个EtO重复单元)在29 ns后与包合物(6 α-CD)结合,并在100 ns内保持聚集(f)。三种情况下,两个分子聚集过程中的相互作用能变化表明,IC/PEO具有最大的结合能(g). h。包裹复合物血小板通过氢键永久交联各向同性PEO半晶结构域。在单轴冷拔下,PEO畴塑性变形形成排列的纤维桥和多孔结构。同时,PEO晶体和链定向并被新形成的PEO晶体暂时固定。水通过破坏PEO晶体引起PEO链反冲和超收缩。包合物交联的PEO收缩后变成无定形富水,使PC-WRAP薄膜变成水凝胶膜。比例尺,1µm (a、b、e);200nm (b,插图);0.5 Å (d);1µm (e,插入)。c中的数据以平均值±s.d表示。从三个样本中。a、b、d和e中的所有实验都重复了三到六次,结果相似。
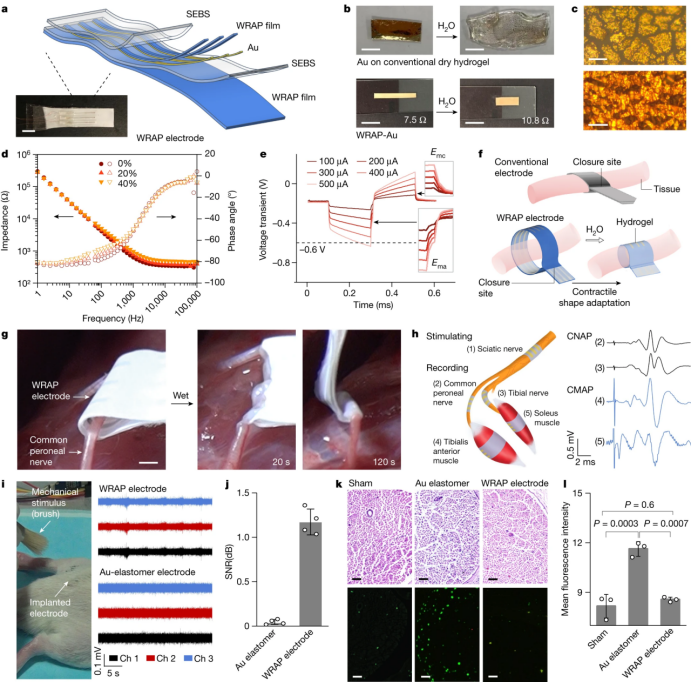
水响应形状自适应电极阵列作为植入式刺激和记录电极。a、柔性缠绕电极阵列示意图(上)和照片(下)。b、Au膜在干燥的聚丙烯酰胺水凝胶和WRAP膜上。润湿使WRAP-Au膜收缩,电阻略有增加。c,各向同性膨胀衬底上不连续的金畴(上)和PC-WRAP薄膜上连续的金网(下)的光学显微镜图像。d,应变(20%,40%)下WRAP电极的阻抗(实图)和相角(空心图)变化。e,测量WRAP电极的Ema和Emc的电压瞬态值,该值应保持在水电解窗口(- 0.6-0.8 V)内。f,示意图显示,与传统电极相比,WRAP电极的植入过程更简单,更安全。g, WRAP电极松散地环绕腓总神经,受湿后2分钟内收缩并适形包裹。h, WRAP电极刺激(100µA)大鼠坐骨神经,同时记录神经和肌肉上的CNAP和CMAP。i,j, ENG信号(i)和它们的信噪比(j)是通过在大鼠坐骨神经上植入2周的WRAP电极和au弹性体电极记录的,以响应每5 s用刷子施加的重复机械刺激。k,l, H&E染色(k,上),CD68免疫荧光图像(k,下)和电极植入2周后坐骨神经束横切面CD68+巨噬细胞的平均荧光强度(l)。P值采用单因素方差分析,然后进行均数差异的Tukey事后检验。比例尺,5mm (a);1 cm (b);20µm (c);1 mm (g);50µm (k)。j中的数据以平均值±s.d表示。来自四种刺激的信号。表1中的数据以平均值±s.d表示。来自三只独立的老鼠。c和k中的所有实验都重复了三次,结果相似。
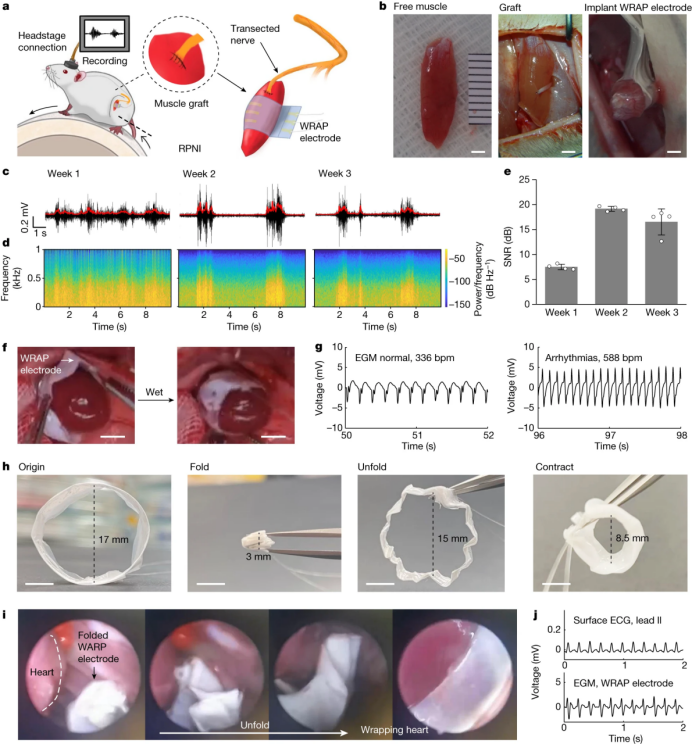
WRAP电极用于RPNI、心外膜记录和微创植入。a,使用WRAP电极记录大鼠RPNI肌电图。RPNI是通过将横断的神经缝合在游离肌肉移植物上而产生的。b,游离比目鱼肌的照片(左),由腓总神经横切固定在游离比目鱼肌上的RPNI(中)和RPNI上植入的WRAP电极(右)。c、d,第1、2和3周RPNI记录的肌电信号(c)和频谱图(d)在第2周振幅增强。红线代表他们的RMS信封。e,肌电信号信噪比在第2周时达到最佳,但在第3周时有所下降并趋于不稳定。f,水诱导形状自适应植入大鼠心脏表面的圆形WRAP电极的照片。g,心律正常(左,约336 bpm)和乌头碱引起的快速起搏性心律失常(右,约588 bpm)大鼠心外膜EGM的WRAP电极记录。h,照片显示一个圆形(直径17mm)的WRAP电极,由防水包装层保护,可以折叠到3-5毫米,并展开回直径约15mm的圆形。受潮后,它的直径缩小到8.5毫米左右。照片显示圆形WRAP电极在大鼠心脏上的微创植入。一旦进入胸腔,折叠的WRAP电极展开,便于安装,当腔内的水触发时收缩并包裹在心脏周围。j、肢体导联电极和微创植入大鼠心脏的WRAP电极同时记录体表心电图(ECG)和EGM。比例尺,2mm (b)和5mm (f,h)。e中的数据以平均值±s.d表示。根据一只老鼠的四个动作信号。
