Nature Materials:凝胶-凝胶相分离!


动态生命系统中的液-液相分离产生无膜组织结构,例如核仁、应力颗粒和Cajal体。液-液相分离是生命科学中的一个新兴挑战,与多种疾病的发展相关,包括白内障和神经退行性疾病。由于大分子的存在,相分离在生命系统中被广泛观察到。由于摩尔质量大,与小分子相比,大分子不利于混合,因为混合熵取决于分子的数量。
使用具有较低临界溶解温度 (LCST) 的单体进行聚合可以引起相分离。聚(N-异丙基丙烯酰胺)在略高于LCST的恒温下聚合时在水中表现出相分离。最初,反应混合物是透明的,因为单体与水混溶。随着反应的进行并且摩尔质量超过临界值,LCST出现,然后随着摩尔质量的增加而降低。当LCST低于反应温度时,发生微相分离。通过引入交联剂形成相分离凝胶可以阻止微相分离。这种相分离凝胶是由显示LCST的聚合物制备的。
这项研究确定了由凝胶化引起的相分离,即渗滤过程。在整个渗滤过程中,凝胶-凝胶相分离(GGPS)发生在水-聚乙二醇(PEG)二元系统中,其相分离在标准大气中从未观察到。GGPS是由异质结构诱发的,该结构通过凝胶化在低于特定值的溶质浓度下被抑制;凝胶化是一个耗散过程,随后的消溶胀过程形成亚毫米级的两个共连续的凝胶相。具有 GGPS 的水凝胶在皮下注射时表现出意想不到的疏水性并诱导脂肪样组织生长,这是在没有GGPS 的类似水凝胶或传统 PEG 水凝胶中未观察到的特征。

图|水凝胶的生物反应过程|产生稀释渗透凝胶和c*凝胶的过程示意图|水凝胶的生物反应过程
亚毫米丝状结构的形成
研究人员通过偶联相互反应的四官能 PEG 前体合成水凝胶,在 25°C 下将 PEG 浓度 (c) 保持在约10–90g/l。这种AB型分子设计抑制包括自咬环在内的分子内反应,同时促进分子间反应形成聚合物网络。这些特征使得即使在c的最低限度 (~5g/l)下也能实现高反应转化率,形成凝胶 (~95%)。通过这种设计形成的凝胶称为四聚乙二醇凝胶。此外,在重叠浓度c*≈60g/l以上形成透明凝胶,c =10称为稀释渗透凝胶。
将凝胶在溶剂(水)中浸泡一周,分别导致c*凝胶和稀释渗透凝胶溶胀和消溶胀。当凝胶从模具中取出并浸入水中时,凝胶达到由渗透压和弹性压力之间的平衡决定的平衡,这分别促进溶胀和消溶胀。大多数凝胶像c*凝胶一样膨胀,因为它们的渗透压超过了弹性压力;而在稀释渗透凝胶中观察到的消溶胀是异常的。有趣的是,稀释渗透凝胶直到从模具中取出才消溶胀。模具的吸附抑制了自由边缘处的收缩,因为凝胶各向同性地收缩和膨胀。因此,凝胶化和消溶胀过程独立发生。
在水中平衡消溶胀/溶胀一周后,研究人员观察了稀释渗透凝胶c*凝胶的介观结构。聚合物主链的四聚乙二醇端基经过 Alexa Fluor 488 部分修饰,经过正染色以进行可视化。研究发现,亚毫米级丝状网络结构仅在稀释渗透凝胶中生长。
稀渗透凝胶的丝状网络结构表现出三个特征。首先,在共焦激光扫描显微镜(CLSM)下,两个相在荧光强度(密相和稀相的荧光强度比为3.2:1)和折射率上表现出明显的差异,证实了两个相之间存在清晰的边界。清晰的边界类似于液-液相分离中观察到的边界。其次,丝状网络结构和周围区域都显示出荧光,表明稀相也含有 PEG 主链。第三,共连续结构的尺寸为10-4 m,是传统网孔尺寸的104倍。然而,制备的c*凝胶和溶胀的c*凝胶均未显示任何特定结构。这一发现很典型,因为聚合物网络的网格尺寸约为10-8m,并且无法通过显微镜观察。
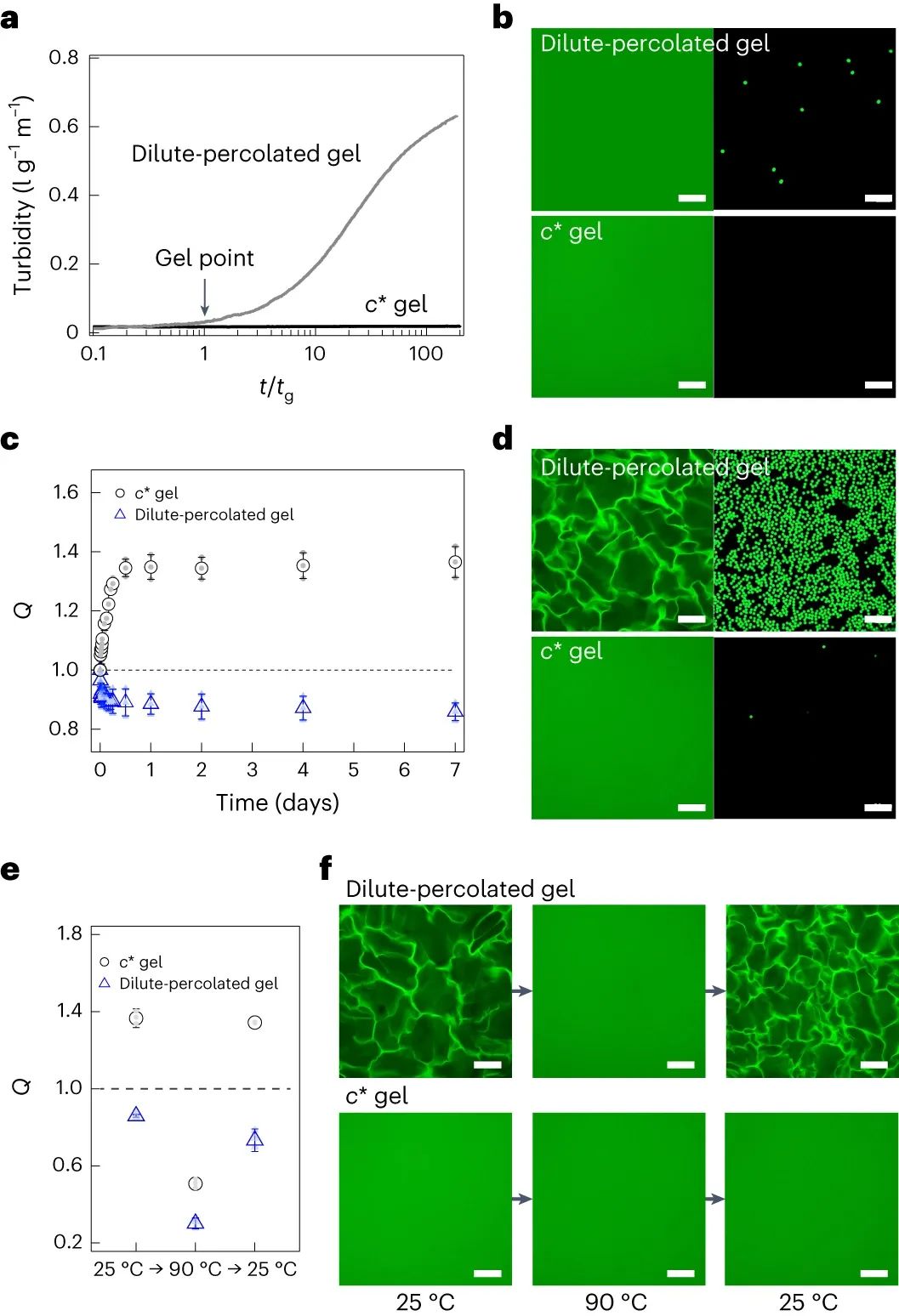
图|水凝胶的生物反应过程|凝胶化过程中的混浊和热力学稳定的亚毫米级相分离结构
GGPS的实验验证
丝状结构是热稳定的。当温度升高到 90°C 时,稀渗滤凝胶收缩,混浊度降低,亚毫米级结构消失。传统的 PEG 水凝胶在高温下会发生收缩,这反映了 PEG 疏水性的增加。然而,将温度从90°C降低至25°C会使稀渗滤凝胶变得混浊,并且丝状结构生长。在此温度范围内,c*凝胶没有表现出形态变化。这些发现证实,稀释渗透凝胶在低于上限临界溶液温度 (UCST) 时会发生相分离,这对于UCST约为300°C的 PEG 水溶液来说是不常见的。在 UCST 以下,稀释渗透凝胶显示出意想不到的疏水性。随着c的降低,即水含量的增加,疏水性逐渐增加。考虑到结构的共连续性,该结果表明稀相也是凝胶态,并且发生GGPS。
这种独特的疏水性亚毫米丝状网络结构是由“c*以下渗透”形成的。另一种 PEG 凝胶(c*稀释凝胶)与稀释渗滤凝胶具有相同的 PEG 和水组成,但最初形成于 c*,没有表现出浑浊度、亚毫米结构或疏水性。因此,c*稀释凝胶和稀释渗滤凝胶之间的唯一区别在于渗滤过程。溶胀增强了聚合物凝胶的异质性。溶胀的c*稀释凝胶中不存在亚毫米结构表明,在消溶胀的稀释渗透凝胶中观察到的亚毫米结构不是在常规凝胶中观察到的典型异质性。
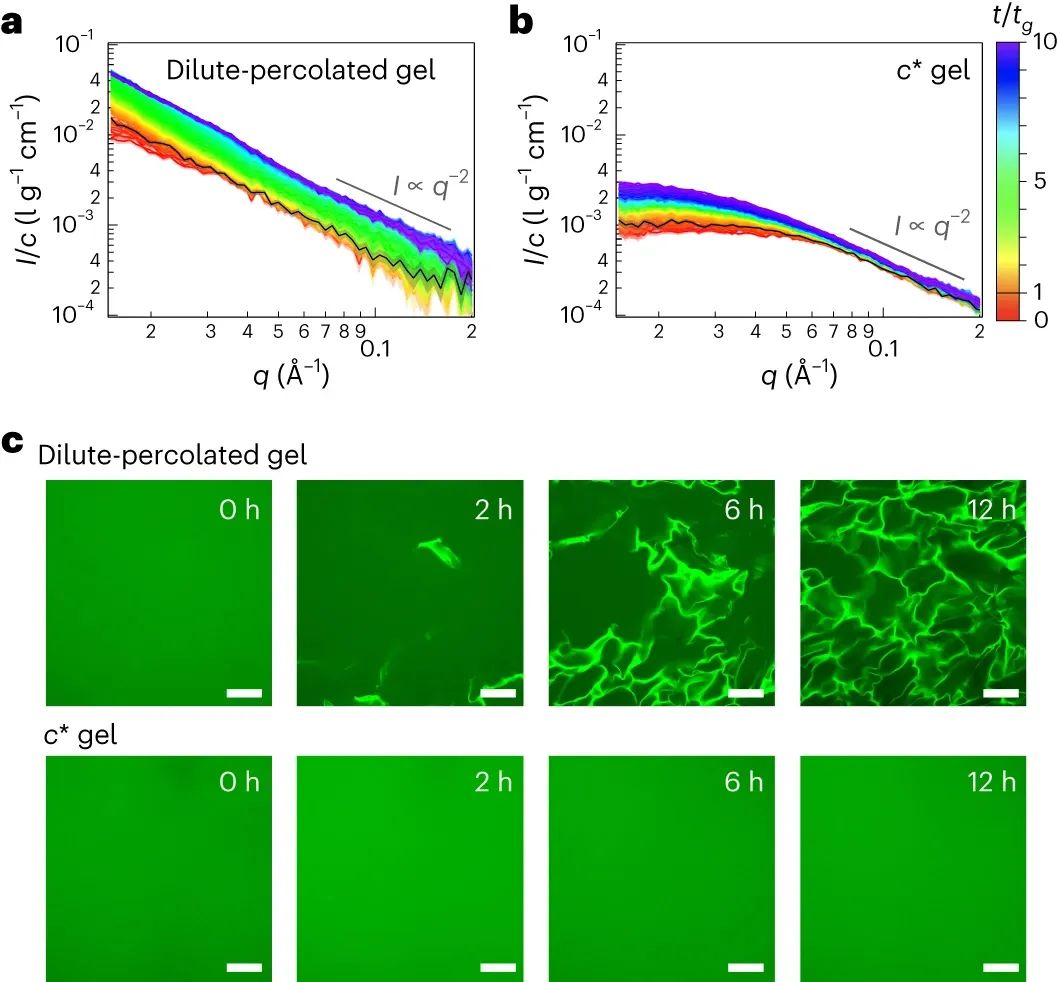
图|水凝胶的生物反应过程|GGPS的形成过程
GGPS的可能机制
在可混溶的 PEG-水二元系统中,凝胶化自发诱导 GGPS。由于稀体系中聚合物前体渗滤过程中的簇团聚,浓度波动扩大,并在凝胶点增长到介观尺度。在凝胶点上方,宏观刚度无限小,因此由聚合物链的一小部分施加。该系统可能具有介观尺度异质弹性分布,其大小对应于凝胶点处的浓度波动。在介观尺度上,具有高弹性,弹性充当吸引力并凝聚相邻的PEG单元。值得注意的是,凝胶点仍远未达到平衡,并且由于凝胶点处的转化率仅为约 60%,因此会发生额外的交联反应,最终增加至 95%。交联反应在凝聚区域有效发生,增强局部弹性。这种积极的反应是由(1)化学能的持续耗散和(2)凝聚相和稀疏相的物质交换驱动的。根据 SAXS,耗散结构在凝胶化过程中被永久冻结。在允许宏观体积变化的开放环境中,发生局部冷凝并形成 CLSM 观察到的独特界面。致密相可能会变得更致密,以最小化界面能量,从而导致 GGPS。因此,均匀的凝胶结构将变得不稳定,并且会出现不均匀的共连续结构并生长到亚毫米尺度,导致均匀的可混溶凝胶系统中的相分离。
水凝胶的生物反应
生命系统中的细胞外基质在不透明性和介观结构方面类似于稀释渗透凝胶。为了证明这一点,将处于平衡膨胀状态的圆盘状水凝胶植入大鼠皮下,并在 14 天的时间内研究了凝胶的生物反应差异。体内成像结果表明两种凝胶的某些生物反应不同,使用稀释渗透凝胶的大鼠的总体发现进一步强调了生物反应;稀释的渗透凝胶与活组织的界面相连。这对于稀释渗透凝胶来说是独特的,但对于 c* 凝胶则不是。
此外还发现,稀释渗透凝胶不仅体积减少,而且随后也发生了脂肪组织的替代。为了进一步研究组织替代机制,我们重点关注巨噬细胞,因为(1)先天免疫细胞识别具有疏水性的分子,(2)巨噬细胞通过分泌活性氧参与基于 PEG 的水凝胶的降解。结果表明巨噬细胞攻击并诱导水凝胶降解,导致组织替代。脂肪样组织的形成通过过氧化物酶体增殖物激活受体(PPARγ)(脂肪细胞的主要调节因子)的免疫组织化学进一步表征。此外,脂肪组织含有CD31阳性的血泡结构。然而,CD68 和 CD31 阳性细胞被限制在植入的 c* 凝胶附近;在该区域没有观察到血管形成。c* 凝胶的惰性性质与之前基于 PEG 的水凝胶的实验一致。因此,只有稀释渗透凝胶在体内溶解并被替换成含有血管结构的脂肪组织。这种行为可能是由调节蛋白质迁移和细胞粘附的疏水性引起的。
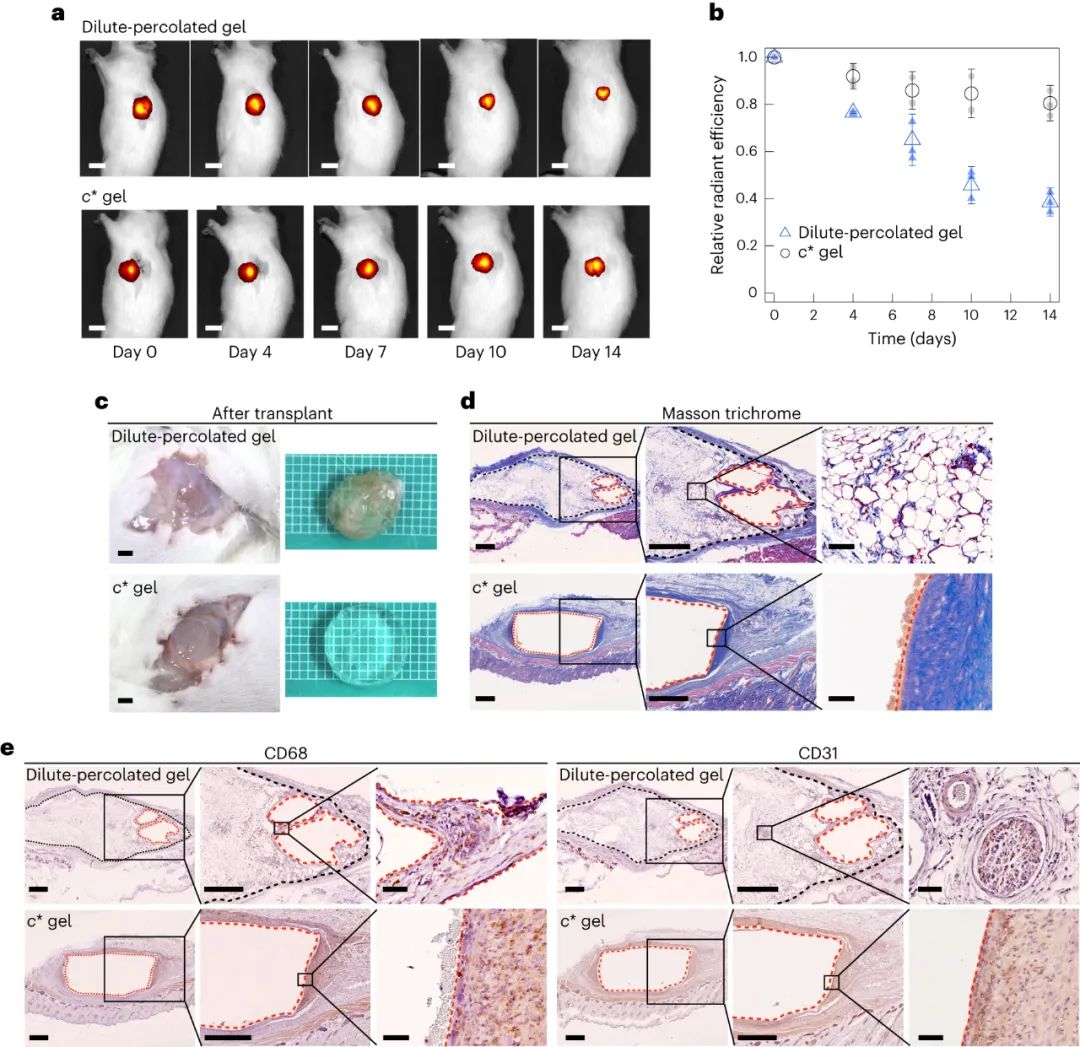
图|水凝胶的生物反应过程|水凝胶的生物反应
小结
综上所述,研究人员证明了凝胶的亲水性和相行为可能受到网络形成的影响。以前,这些特性被认为仅由化学结构决定。PEG水凝胶在室温下通常是亲水性的,LCST为130°C,UCST为300°C。然而,该稀释渗透 PEG 凝胶在室温和低于 90°C 的UCST 下表现出疏水行为。因此,其他稀释渗透凝胶可能因其化学结构而具有意想不到的物理特性。
稀释渗透的 PEG 凝胶具有与细胞相互作用的丝状结构,类似于生命系统中的细胞外基质。PEG 是一种细胞惰性合成聚合物,美国FDA的药物主文件中列出了许多基于 PEG 的生物医学产品。由于严格的生物安全法规,不建议使用生物安全性未知的其他合成聚合物开发生物医学产品。因此,细胞相互作用的PEG凝胶可以促进基于PEG的生物医学产品的开发,例如再生医学支架。
以下几个方面使得完全理解 GGPS 具有挑战性:(1) 特征结构的尺寸在 10 至 105 nm 之间有四个数量级变化;(2) 结构形成所需的时间各不相同,不到一个小时即可形成凝胶化,大约一天完成凝胶反应,最多一周形成丝状结构。揭示这些涵盖广泛长度和时间尺度的现象是一项艰巨的任务。尽管存在这些障碍,但是该研究结果指出了范式转变,证明渗滤过程可以极大地改变凝胶的物理性质,而此前人们认为凝胶的物理性质仅由其化学结构决定。这项研究探索了 PEG-水二元系统中的 GGPS,这可能会激发讨论和进步,特别是在材料科学、软物质物理和生物学领域。
参考文献:
Ishikawa, S., Iwanaga, Y., Uneyama, T. et al. Percolation-induced gel–gel phase separation in a dilute polymer network. Nat. Mater. (2023).
https://doi.org/10.1038/s41563-023-01712-z
