琼脂糖水凝胶《Nautre》:灵感源于电鳗!
原创2023-09-04 00:31·EngineeringForLife
*仅供医学专业人士阅读参考
电鳗是一种生活在南美洲的淡水鱼类,以其引人注目的特殊能力而闻名于世。它们能够通过身体产生电流,并利用这种生物放电来捕食、自我防御以及进行导航。
19世纪初,亚历山大·冯·洪堡(没错,就是“洪堡学者”的洪堡)前往南美洲进行科学考察和探险。他在亚马逊河流域进行研究时,对电鳗的电击能力产生了浓厚的兴趣。他想要了解电鳗的生物放电机制,并且想要亲自体验一下电鳗的电击。于是,他请来了一位印第安导游,带着一些木质的绝缘工具,前往亚马逊河边寻找电鳗。当他们发现一条电鳗时,洪堡用木制的触电棒去刺激电鳗来感受电击。然而,事情并不如他所料。电鳗对于亚历山大·冯·洪堡的触电棒并没有反应,它似乎并不打算发动攻击。于是洪堡决定换一种方法。他用手直接触摸电鳗,结果被电击得晕了过去。
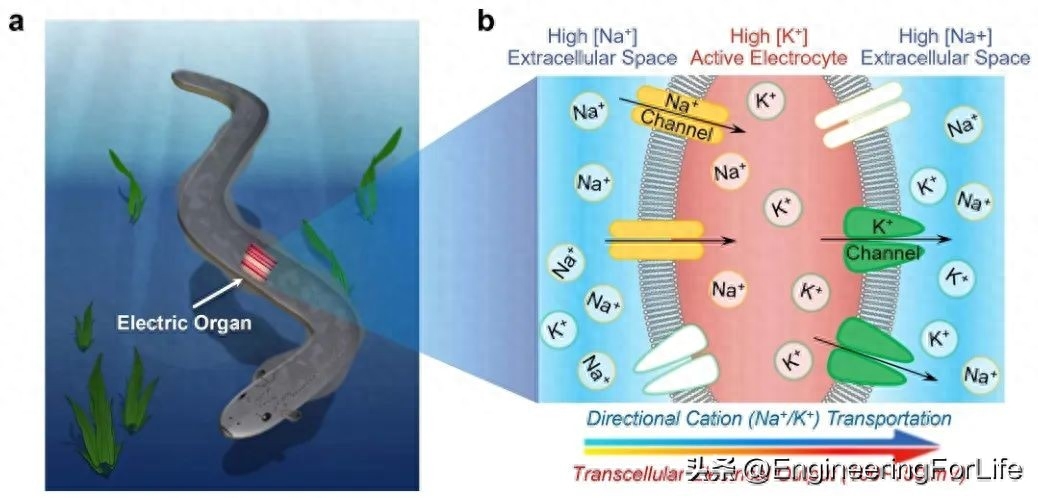
图 电鳗发电
电鳗的生物放电是由其特殊的电器官所产生的。这个电器官位于电鳗的身体两侧,占据了大部分身体空间。电器官由成百上千个电气细胞组成,每个细胞都被称为电气板(electroplax)。电气板内部有丰富的离子通道和离子泵,形成了一个高度复杂的电生理系统。当电鳗需要进行放电时,电气板会产生大量的电流。这是通过电气板内部的离子泵将钠离子和钾离子分别积累到不同的浓度上实现的。电鳗的电气板内部负责维持高钠离子浓度的区域是阳极,而维持高钾离子浓度的区域是阴极。当电鳗需要放电时,这两个区域之间的电位差会产生,驱动电流的流动。
生物电源可以作为理想的微型电源,其应该具有生物相容性、机械灵活性,并能产生离子电流以刺激生物,而不是像传统电子设备那样使用电子电流。当前,一种有效的方法是使用受电鳗启发的软电源,然而,目前还没有生产出具有实用功能的微型电源,因为要获得既能在使用前保存所含能量又能轻松触发以产生能量输出的微型装置具有很大挑战性。
来自英国牛津大学的Yujia Zhang、Linna Zhou和Hagan Bayley团队:
①通过沉积以脂质为支撑的纳米液滴水凝胶网络,基于其内部的离子梯度产生能量的原理开发出一种微型软电源;
②与最初受鳗鱼启发的设计相比,本研究可将装置的体积缩小 105 倍以上,而且可储存能量超过 24 个小时,其能够实现按需运行,功率密度比传统电力装置提高了 680 倍,达到约 1,300 W m-3。
本研究提出的液滴装置可作为生物相容性和生物离子电流源,用于调节三维神经微组织和体外小鼠脑切片中的神经元网络活动。最终,本研究的软性微尺度离子电子装置可能会集成到生物体内。相关工作以题为“A microscale soft ionic power source modulates neuronal network activity”的文章发表在2023年8月30日的国际顶级期刊《Nature》。

1. 创新型研究内容
电鳗(Electrophorus electricus)的发电能力依赖于成千上万个电细胞的串联堆叠,其中阳离子 Na+ 和 K+ 可在浓度梯度的驱动下通过细胞膜上的离子选择性蛋白通道单向传输。本研究模仿了鳗鱼电器官的总体布局和机制,将五个纳升级预凝胶(琼脂糖)液滴依次组合在一起(图 1)。在一个单元中,液滴的顺序是:高盐(例如 CaCl2、KCl 或 NaCl)、选择性阳离子、低盐、选择性阴离子和另一个高盐液滴。它们通过电子微注射器沉积在含脂油中。液滴最初被单层脂质包围,在相互接触后几秒钟内形成液滴界面双层(DIB),从而形成稳定的无支撑结构。为了激活电力源,本研究将组装好的液滴移入无脂油中以去除脂质并分解 DIB。然后将液滴在 4℃下凝胶化,形成连续的水凝胶结构。
本研究还测量了激活前后单个电力装置的电力输出。激活前:含脂油中的液滴(每个 50 nl,盐浓度梯度为 200 倍)通过 DIB 相互粘附。本研究将这些结构在环境温度(25 ℃)下放置 5 分钟,使液滴部分凝胶并达到平衡。当将电极插入高盐度的两端液滴时,没有记录到电流,这表明 DIB 的绝缘性阻止了能量耗散。激活后:本研究用无脂油去除脂质,并在 4 ℃下进行完全的凝胶化,从而建立了离子导电通路。激活的液滴电源在开路时产生 127 mV 的电压(VOC),该值与单个电解质产生的电位(100-150 mV)相当。短路电流(ISC)在几秒钟内达到 2.2 μA 的峰值,然后由于所含盐分的数量有限(两个高盐液滴中各含 100 nmol)而下降到较低值,这与模拟结果一致。输出电流在 30 分钟后仍然存在,数值约为 30 nA。此外,由于水凝胶成分和绝缘 DIB 的坚固性,液滴电源可以按需存储和使用。本研究将液滴电力源储存在含脂油中,以测试能量随时间的变化情况(图 1f)。激活后,液滴电源在储存 36 小时后的挥发性有机化合物变化不到 10%。同期,由于水分流失,液滴的体积略有下降。
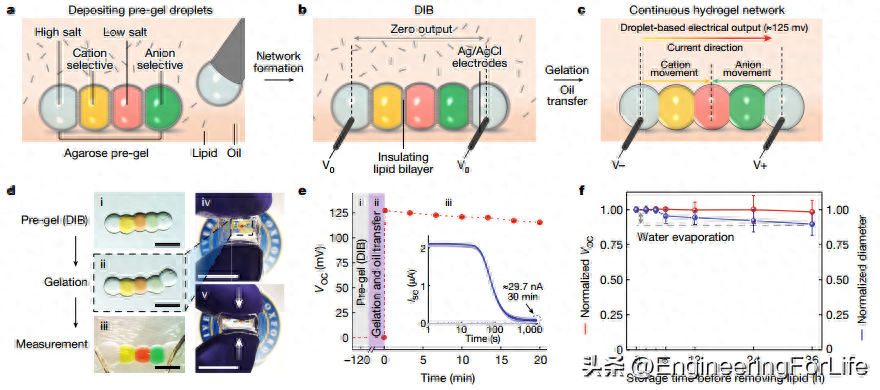
图1 液滴电源的结构和输出性能
为了提高液滴电源的输出性能,本研究根据反向电渗析原理分析了影响生物电行为的几个关键参数:选择性渗透膜上的离子梯度会在膜上产生电电力。首先,对盐的类型、浓度梯度和外部电阻进行了优化。在盐浓度相同的情况下,氯化钙产生的输出电压比氯化钠和氯化钾高。带电的有机化合物在特定条件下也能产生浓度梯度,并可用于构建电源。提高高盐液滴和低盐液滴之间的浓度比(梯度)可增加输出电压,但由于液滴电源的内阻增加,降低低盐浓度以产生更大的浓度比会导致输出电流下降。然后,本研究使用最佳的 200 倍 CaCl2 梯度,测量了输出电压、电流和功率与外部电阻的关系,结果显示由 50 nl 液滴组成的电源装置的电阻约为 78 kΩ,最大输出功率约为 75 nW。
使用脂质支持的水凝胶液滴制造软电源的优势之一是易于微型化。将液滴的体积从 1,000 nl减小到 1.84 nl,减少了 99.8%,结果导致输出电压(36%,从 136 MV减小到 87 MV)和电流(70%,从 2.7 μA减小到 0.83 μA;图 2)同时下降。这些下降可能是由于液滴内阻的增加以及选择性液滴上浓度极化的增加。事实上,1.84 nl 液滴在电阻匹配处的平均能量密度大大增加了约 100 倍,达到约 1,300 W m-3,与之前的鳗鱼启发设计相比增加了约 680 倍,与随后的纸凝胶设计相比增加了约 5 倍。虽然小型化电源释放的总电荷量较低,但可以将多个电源单元串联和/或并联,以增加输出电压和/或电流。VOC 随串联单元数量的增加而增加;ISC 和总释放电荷随并联单元数量的增加而增加(图 2c)。
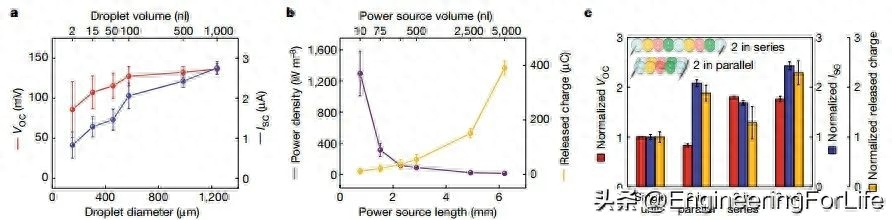
图2 液滴体积对液滴电源电气特性的影响
对于更大规模的液滴网络,在不增加液滴厚度的情况下增加不同功能液滴层之间的接触面积非常重要。这是因为液滴的内阻与接触面积呈负相关,而与厚度呈正相关。因此,在增加串联或并联单元数量的同时,保持低内阻(小尺寸)可分别增加输出电压或电流。为了扩大小液滴的组装规模以实现更大规模的应用,本研究采用了模板法,将多个液滴沉积到3D打印的树脂模具中,生产出预先设计好图案的功率单元(图 3)。模板辅助下的球形单元自组装(从纳米级到微米级)已被广泛用于制造图案结构,而且单元之间的吸引力和模板内的约束是自组装的两个必要条件。在本研究的方法中,脂基 DIB 的形成提供了液滴之间的吸引力(弹簧常数约为 4 mN m-1,拉伸强度约为 25 Pa),而模具的边界限制了它们的分离。本研究制备了内径为 600 μm 的圆柱形模具,比 4 nl 液滴的直径大三倍。在每个模具中,沉积了 7 个液滴(4 nl),它们在几秒钟内自发地组装成六边形的 “花朵状”图案(图 3c、d)。接下来,本研究在一个更深的圆柱形模具中堆叠了五个自组装的液滴六边形,其内容相当于一个电力装置的五个液滴,从而形成了一个更大的三维电力源网络。一个由 20 个六边形(28 个单元,140 个液滴)组成的更大网络的构建时间不到 10 分钟(图 3e)。利用3D液滴打印机可以实现构建过程的自动化,从而生产出由数千个电力单元组成的液滴网络。
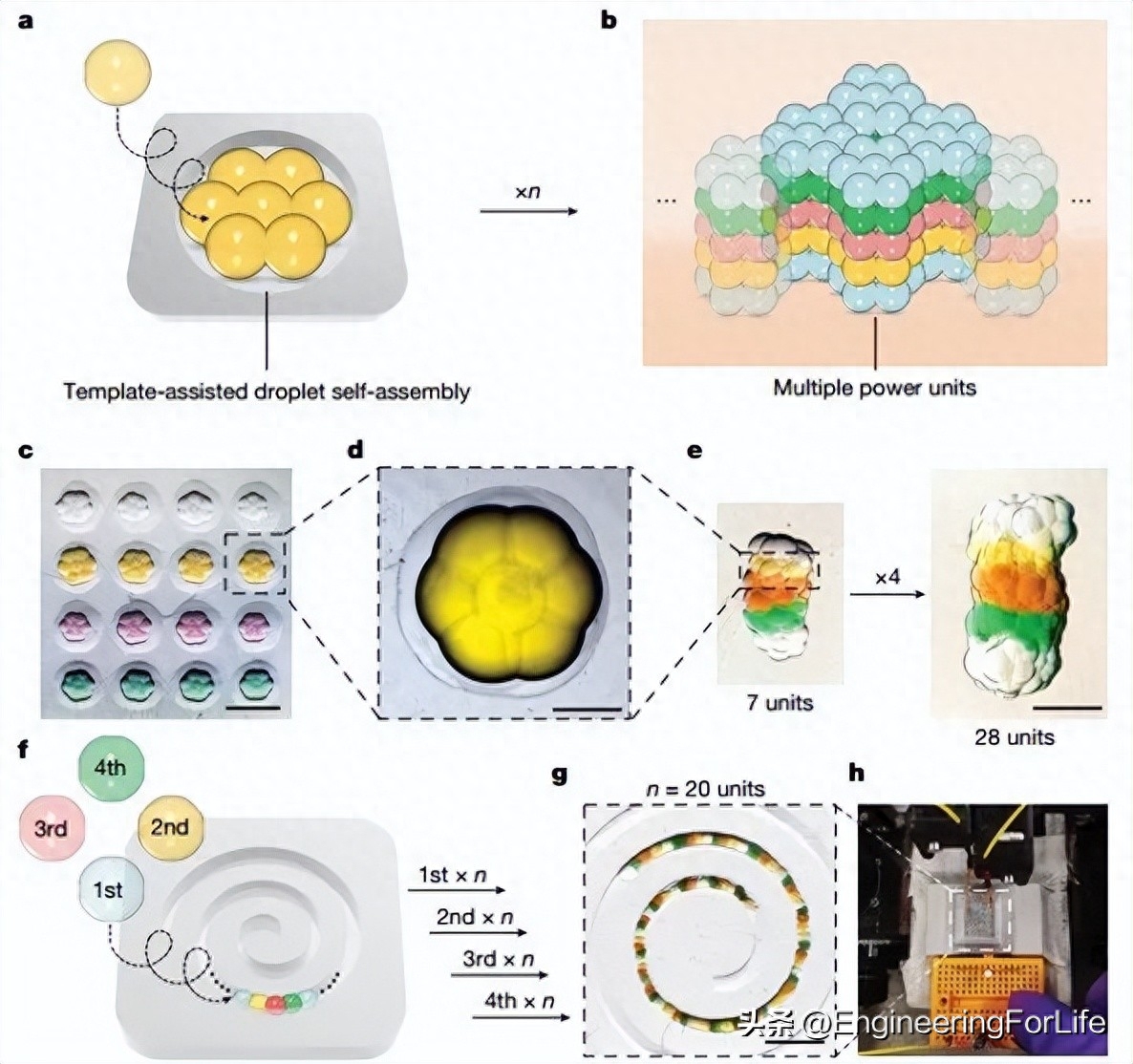
图3 模板辅助液滴网络制造和输出
本研究关注了液滴装置对神经元活动的影响。高盐和离子选择性液滴可共同作为一个开放的液滴装置,通过其终端连接到外部元件(图 4)。当这种开放式装置连接到离子浓度较低的液滴上时,就会形成一条导电通路,使离子电流(约 2.6 µA)流经连接的液滴(图 4b、c)。如果神经元嵌在低盐液滴中,产生的细胞外离子电流将调节单个神经元的活动,进而反映神经元网络的活动。为了验证这一点,本研究使用微流体设备生成了神经微组织,它由载满人类神经祖细胞的 Matrigel 球体(直径约 570 μm)组成。神经微组织涂上含有神经元培养基的低盐琼脂糖水凝胶,形成含有神经元的液滴(图 4a,红色液滴)。然后将液滴装置连接到圆形容器中的含神经元液滴上。在高盐液滴中含有 0.5 M CaCl2 的情况下,通过使用 PrestoBlue 进行细胞存活率检测、使用钙黄绿素 AM 和碘化丙啶进行活死细胞染色以及使用神经元标记物 TUJ1 和细胞凋亡标记物 caspase 3 进行免疫荧光染色,神经元在附着 10 分钟后仍保持着很高的存活率。神经元活动是通过共焦成像进行测量的,使用的是细胞内钙染料Fluo-4 Direct,它对细胞外的钙离子无反应。延时记录显示了液滴装置连接到含有神经元的液滴时神经元的时空调制过程。神经元活动与离子电流的相关性表明,神经元活动是由液滴装置引起的,而不是自发产生的。
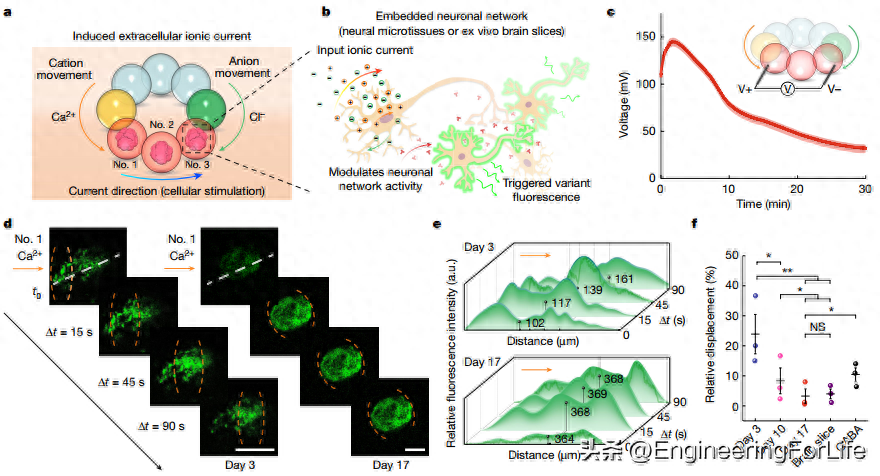
图4 离子微滴装置对神经元的调制作用
2. 总结与展望
SEBS 和其他封装方法可能会为使用离子电源为可穿戴设备和其他移动设备供电打开大门。不过,该方案还有进一步改进的空间。理想的电源应在生理环境下工作,这样才能在体内用于生物调节。目前的液滴电源利用温度变化来不可逆地触发其活动,并且需要 SEBS 封装才能在水环境中工作。将水性转移与脱湿法以及使用可控光的脂质或膜蛋白相结合,可以在水性环境中生产出具有远程可逆开关的三维打印液滴电源,从而实现在体内的应用。在此基础上,在水凝胶中加入磁性微粒等其他刺激响应材料,可赋予其远程控制的流动性,从而在体内向封闭的生物环境输送能量。未来的研究应侧重于在生理条件下利用该装置并提高其总体能量容量,然后将其用于为下一代生物混合界面、植入物、合成组织和微型机器人提供电力。液滴装置还为调节各种微型细胞构建体(如脑器官和组装体)的活性铺平了道路。
