水凝胶再创新,又发Science大子刊!
01研究背景
协调天然生物组织和工程材料之间的不匹配,代表了先进生物医学设备和组织工程平台发展的关键需求。然而,天然组织表现出许多难以用合成材料复制的特点。例如,肌腱是由排列整齐的胶原纤维与柔软的含水生物聚合物交错组成的分层组织。它们含有约60 wt%的水,同时表现出千兆帕级的高模量和55-120 MPa的强度。肌腱的各向异性结构不仅为肌肉骨骼系统提供了必要的承重能力,而且还提供了重要的生物物理线索,通过界面的相互作用转化为细胞的行为。
在过去的十年中,大量的研究工作致力于具有高结构各向异性的仿肌腱材料的工程。例如,拉伸应力被用于聚合物网络的定向,导致水凝胶沿拉伸方向的机械强度增强。多个网络或物理交联被结合到水凝胶,以提高断裂韧性。最近探索了由冷冻和盐析引起的相分离,以产生分层结构,进一步改善水凝胶的力学性能。然而,这些各向异性的水凝胶的模量仍然比天然肌腱的模量低几个数量级,部分原因是亲水聚合物链在水存在下的柔性。加入纤维素或合成聚合物的成束纤维可能赋予水凝胶复合材料高硬度。然而,要控制刚性纤维和软基质之间的相互作用,以模仿承重软组织中的微观结构的相互作用,这是一个挑战。因此,天然肌腱的许多机械行为,如应变硬化和粘弹性反应,仍然难以用纤维增强的水凝胶复制。此外,以前在仿肌腱材料方面的努力大多集中在机械性能的工程方面。对材料的功能化给予了有限的关注,使其能够与细胞和组织形成生物活性界面,因此限制了其在生物医学上的应用潜力。
02研究成果
在这里,香港大学徐立之团队报告了一个材料平台,用于构建具有类似肌腱行为和多功能生物界面的混合各向异性水凝胶。刚性芳纶纳米纤维(ANFs)和柔性聚乙烯醇(PVA)之间的可重构的相互作用允许组装高度定向的网络,模仿排列的胶原纤维和软蛋白多糖之间的微观结构的相互作用。由此产生的各向异性复合水凝胶(ACHs)表现出与天然肌腱相匹配的高机械性能,同时保留了类似的约60%的水含量。ACHs的生物功能化成为可能,为细胞行为的调控提供了各向异性的生物物理线索。软生物电子学可以进一步集成到ACHs上,使混合装置能够在现场传感和刺激。这些肌腱模拟物的力学和功能表明它们有机会应用于先进的生物医学技术。相关研究工作以“Multifunctional tendon-mimetic hydrogels”为题发表在国际顶级期刊《Science Advances》上。祝贺!

03图文速递
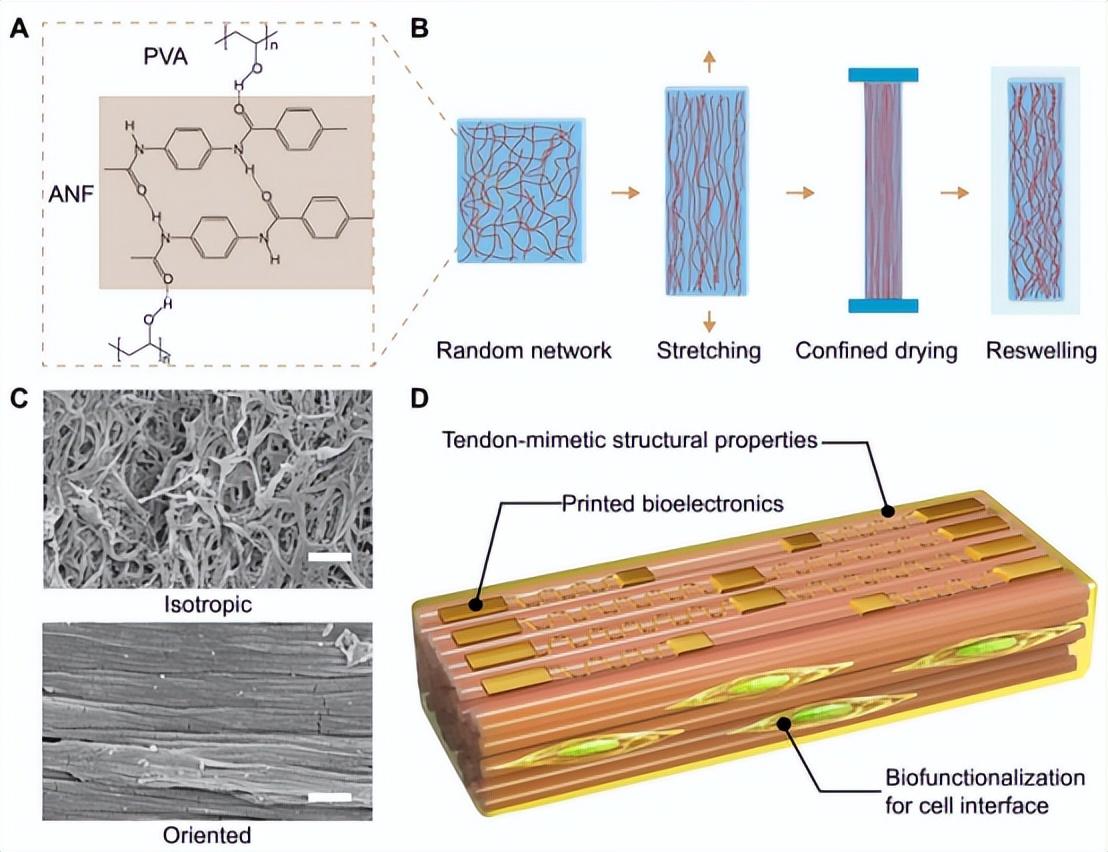
图1. 仿肌腱ACHs的设计和加工
ACH的制备包括对由ANFs和PVA组成的各向同性水凝胶进行拉伸和限制性干燥。ANFs表现出纤维直径为5-30 nm、长度为3-10 µm的分支微结构,为复合材料提供了模仿胶原蛋白的构建块。ANFs和PVA之间广泛的氢键赋予了三维(3D)网络的可重构性和高韧性(图1A)。在单轴拉伸下,纤维状网络沿着拉伸方向定向,即使在80%的应变下也不会出现结构解体(图1B和图S1)。接下来,水凝胶样品在大气中进行干燥(约50%的湿度),其长度固定在拉伸方向上(表S1)。这个步骤有利于纤维间的相互作用,导致纤维网络的永久排列。样品在水介质中的各向异性再膨胀行为导致ACHs的平衡水含量约为60%至74%,类似于天然肌腱(表S1)。扫描电子显微镜(SEM)图像证实了ACH的高度定向纤维状网络,与各向同性的ANF-PVA水凝胶形成对比(图1C)。此外,在ACH中观察到纤维的捆绑和卷曲,类似于天然肌腱中的分层结构(图S2)。各向异性的微观结构在整个毫米级样品的深度上看起来是一致的(图S3),导致ACH的强大机械行为。此外,PVA链可以提供进一步的化学功能化,使细胞的生物活性界面或与多功能生物电子设备集成(图1D)。
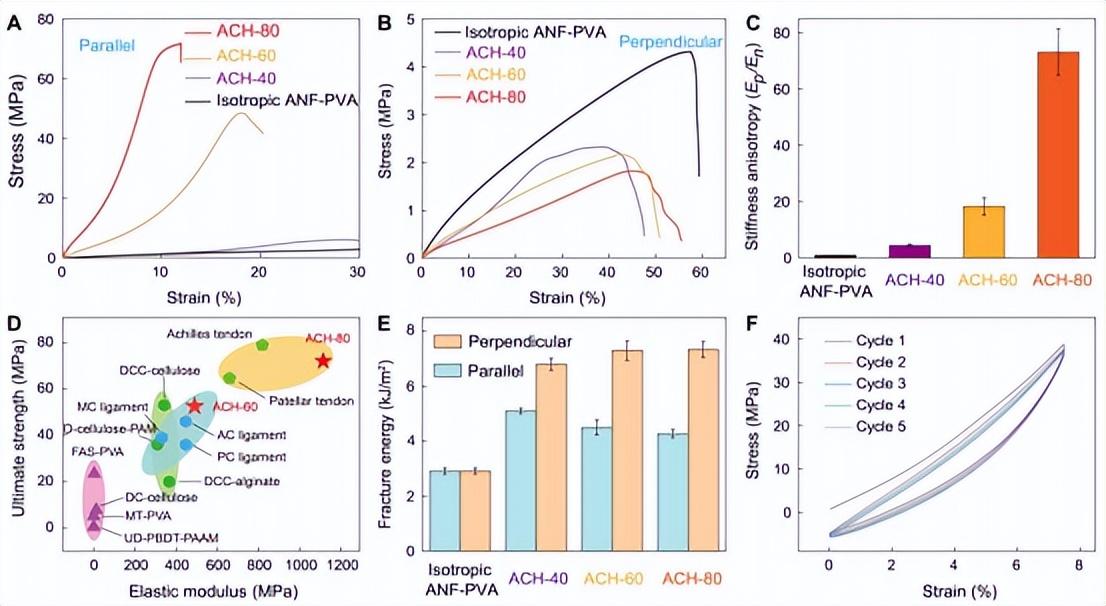
图2. ACHs的机制
拉伸诱导的纤维状网络的取向影响了ACH的力学特性。他们调查了各种样品,表示为ACH-x,x是预拉伸-干燥过程中施加的伸长率。从微观结构观察,在预拉伸-干燥过程中,ACH的纤维排列和捆绑的程度随着伸长而增加(图S4)。此外,在高度拉伸导向的样品(如ACH-80)中,纤维间的相互作用导致了膨胀状态下的高固体含量(约40%),这与那些以较低的预拉伸处理的样品形成对比(图S5)。因此,在平行于纤维排列的方向上,ACH的模量和强度与预拉伸干燥过程中施加的伸长程度密切相关(图2A),ACH-80表现出最高的弹性模量1.1GPa和强度72.1MPa(图S6和S7)。这些值比含水量相似的各向同性的ANF-PVA水凝胶的模量和强度高约65倍和约10倍(图S8和S9),表明微结构各向异性对ACHs的力学的贡献。另一方面,拉伸诱导的取向导致ACHs在垂直于纤维排列方向的强度下降,部分原因是刚性纤维对承载的贡献减少(图2B)。ACHs的刚度各向异性,以平行于和垂直于纤维排列的初始拉伸模量之间的比率为特征,可以调整到~80的水平(图2C),这涵盖了生物组织的内在范围。值得注意的是,ACH-80的弹性模量和机械强度与天然肌腱的弹性模量和机械强度相匹配,这是其他具有肌腱模仿特性的合成水凝胶所不能达到的(图2D)。这些特性在水环境中是稳定的(图S10)。此外,ACH在平行和垂直于预拉伸的两个方向上都表现出高韧性(图2E和图S11)。值得注意的是,ACH中排列整齐的纤维对垂直于其方向的裂纹扩展提供了更大的阻力,导致断裂能量高达7333 J/m2。
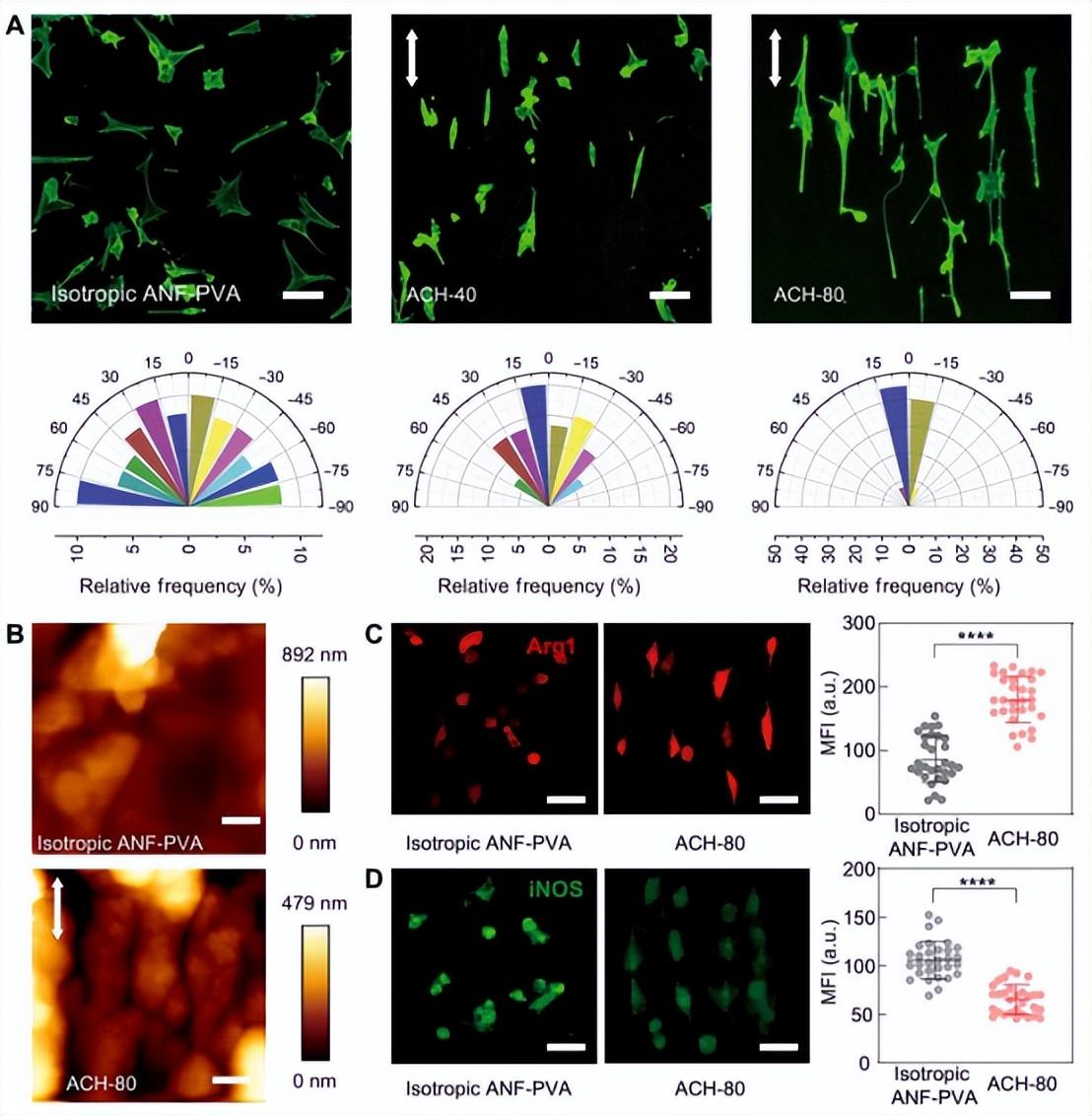
图3. 用生物功能化的ACHs调控细胞形态和表型
ACHs的结构各向异性明显转化为附着细胞的形态。各向同性的ANF-PVA水凝胶导致附着的成纤维细胞随机排列,而ACHs诱导了细胞的显著定向,定向程度随着纤维的排列而增加(图3A)。细胞的形态可以由细胞外基质的各种结构因素调节,如各向异性的硬度、表面形貌或粘弹性反应。ACHs具有许多这样的特性,它们可以通过机械感应和机械传导共同影响附着细胞的行为。进一步的研究表明,自组装的表面拓扑结构是ACHs上细胞定向的主要贡献者。具体而言,原子力显微镜(AFM)(图3B)和光学显微镜(图S16)都显示ACHs表面有排列整齐的微槽,间距大小从0.2-20 µm不等,为细胞定向提供接触指导。另一方面,用等离子体蚀刻去除ACH的表面拓扑结构,导致附着的细胞的定向性大大降低(图S17)。众所周知,由Rho相关蛋白激酶(ROCK)介导的细胞收缩机制在它们对表面形貌和基质力学的形态反应中起着重要作用。对于在ACH上培养的成纤维细胞,添加ROCK抑制剂Y-27623导致细胞的定向降低(图S18),这证实了细胞-ACH界面上的机械感应和机械传导过程对各向异性的形态发生有影响。
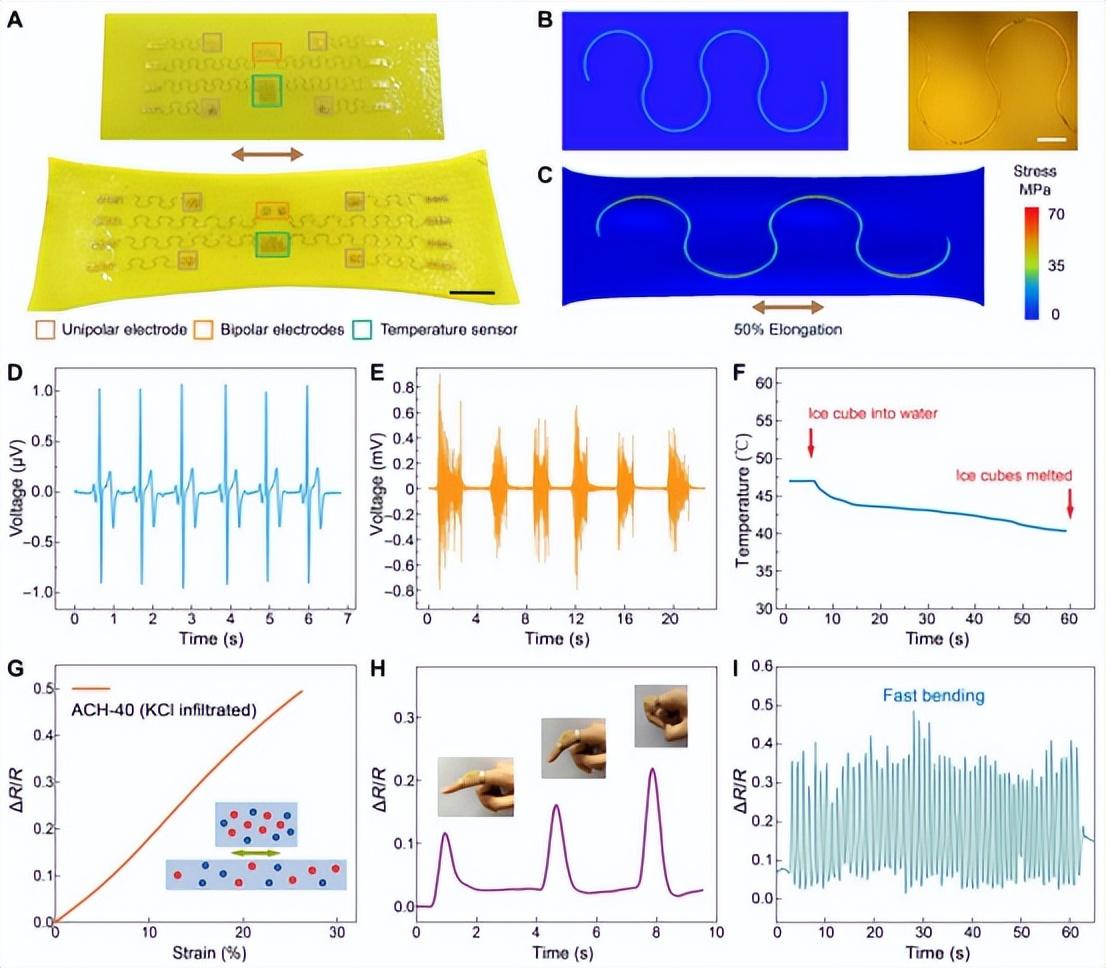
图4. 具有集成的多功能生物电子学的ACHs
最后,他们通过集成的软生物电子学展示了ACH的多模态生理感应。具体来说,ACH的液体前体中PVA链上的羟基可以与微制造器件的功能化表面相互作用(图S20)。通过溶剂交换凝固后,ANF-PVA水凝胶和转移印刷的电子元件之间形成了稳定的结合(图4A)。晶圆制造的电子元件采用了蛇形设计,它赋予了高拉伸性以承受ACHs的预拉伸-干燥处理(图S21至S23)。正如有限元分析(FEA)所表明的,在50%的拉伸过程中,代表性蛇形装置的应力分布明显低于组成材料[如聚酰亚胺(PI)和金]的失效阈值(图4,B和C)。可以想象,电子元件的可伸展性可以通过修改它们的几何设计而进一步增强,这可以帮助在更高的伸长率期间保持它们的机械完整性。为了证明感官功能,ACH上的生物电极阵列被用来描述来自皮肤的电生理信号,获得高质量的心电图(ECG)和肌电图(EMG)的记录(图4,D和E)。基于封装的薄膜电阻的温度传感器即使在水介质中也表现出良好的反应(图4F和图S24),这表明它们在植入配置中的能力。ACH上的这些功能部件仅具有代表性。由于微细加工和转移打印技术的多功能性,许多其他生物传感器和执行器可以被结合到这个平台。此外,他们设计了一个基于ACHs离子电导率的应变传感器。具体来说,用氯化钾浸润的ACH样品的电阻随着施加的伸长而增加,显示出约2.5的典型规范因子(图4G)。这种基于ACH的传感器能够在各种振幅(图4H)和频率(图4I)下表征关节的运动。
04结论与展望
总之,研究者已经开发出了仿肌腱的水凝胶,其出色的力学和功能源于纳米纤维复合材料的各向异性组装。ACHs提供的生物物理线索可进一步用于控制细胞的分化、迁移和其他活动,这有助于扩大先进组织工程的工具箱。另一方面,ACHs的一系列仿肌腱行为表明它们有可能被用作可植入的组织修复体。在这方面,ACHs和体内自然组织之间的物理整合可能需要进一步的工程关注。集成在ACH上的多功能生物电子学可以为各种生理参数的现场监测提供关键能力。与无线模块的结合应能实现完全植入的系统,允许外部控制硬件和电子活动假体之间的双向通信。
