光催化CO₂还原:基础知识(一)
随着人口和工业化程度的快速增长,全球能源供应急剧增加。据估计,截止到2021年全球能源消耗总量约为600 EJ (1018 J),其中超过80%的能源供应来自于化石燃料[1]。而化石燃料的使用会引起严重的CO₂排放。
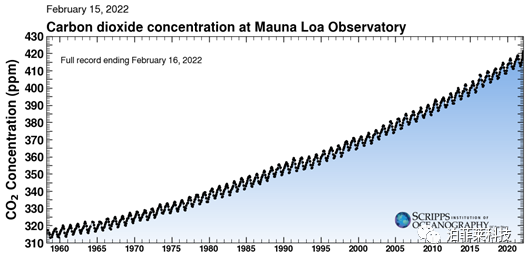
最新统计数据表明,大气中的CO₂含量从工业革命前的280 ppm上升到2020年的416 ppm(图1)[2]。CO₂的过量排放会带来全球变暖、冰川融化、生物多样性丧失等一系列问题[3,4]。因此,CO₂的转化利用已经迫在眉睫。
01
迄今为止,已经发展了多种技术可将CO₂转化为碳氢化合物或高附加值化学品,主要包括热催化[5,6]、生物催化[7]、光电催化[8,9]、电催化[10,11]和光催化还原[12-14]等。
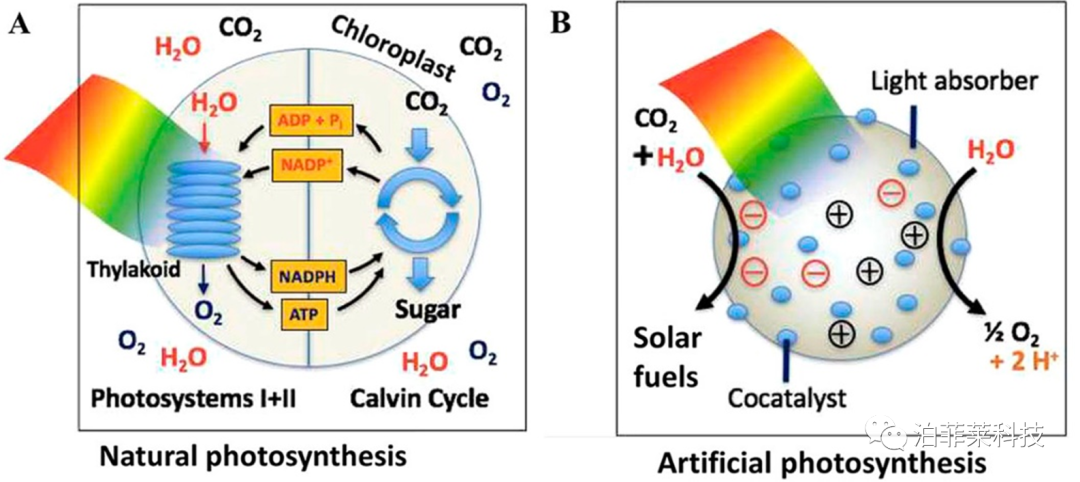
传统热催化还原CO₂要在高温(至少500℃)和高压(10 bar)条件下进行[15]。光催化CO₂还原过程模拟自然光合作用,利用太阳能和光催化剂将CO₂和H₂O进行催化转化(亦称人工光合作用),在常温、常压条件下便可实现太阳能燃料和高价值化学品的生产,如:甲醇、乙醇、碳氢化合物等[16,17],如图2所示。因此,光催化CO₂还原也被认为是解决全球能源和环境问题的最有前途的方案之一。近年来,光催化CO₂还原的相关研究日渐增多。
相比于传统热催化方法,该反应具有如下四大优势[18]:
① 反应外部能量供应仅为太阳能,取之不尽用之不竭;
② 反应以H₂O和CO₂为反应原料,易于获取;
③ 反应条件温和,一般为常温、常压;
④ 反应无二次污染。
02
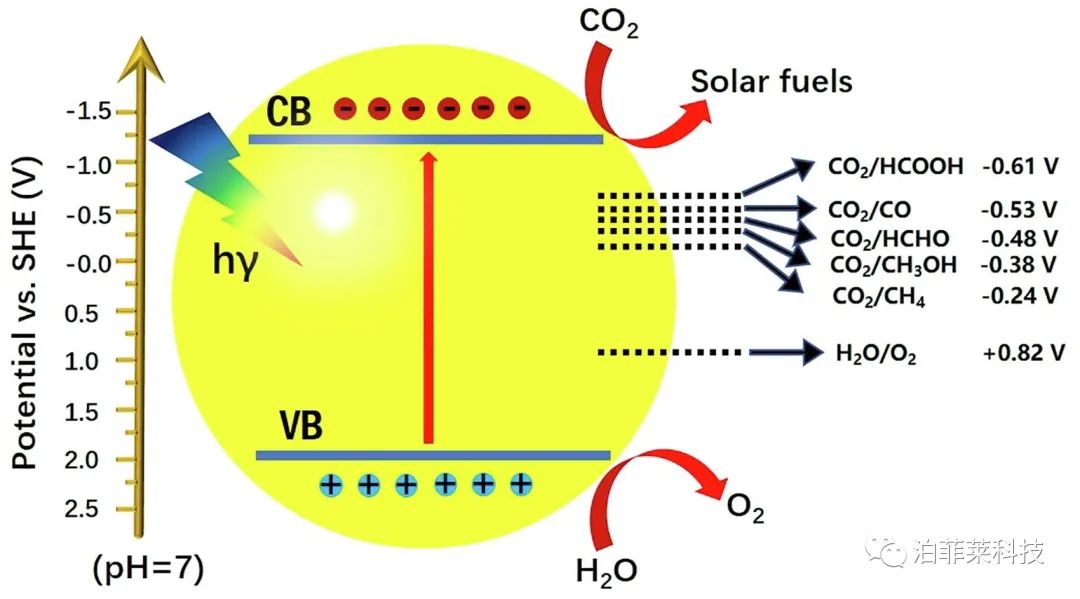
光催化CO₂还原反应是一个复杂的多步过程。一般情况下,该反应过程主要涉及如下三个步骤[18]:
① 半导体光催化剂受到能量大于其禁带宽度(Eg)的光激发;
② 光生电子和光生空穴的分离;
③ 光生电子迁移到光催化剂表面与CO₂和H+发生反应并形成还原产物,光生空穴与H₂O发生氧化反应产生O₂。
整个光催化CO₂还原反应过程可以在纯气相中发生,也可在溶液体系中发生[16]。
03
① CO主要可被用作费托合成反应的原料气,用于生产高碳类化学品;
② CH4是天然气的主要成分,同时也可被用于CO₂的重整反应;
③ 液态产物CH3OH和HCOOH主要可被用于燃料电池,CH3OH也可作汽油的添加剂;
④ 乙烯主要用于聚乙烯和乙二醇的生产,乙烷用于制备乙烯。乙醇主要应用于化学溶剂、医疗和燃料中;
⑤ 乙二醇用于聚乙烯对苯二甲酸酯(涤纶的原料)的生产。
04
CO₂的C=O键能高达750 kJ·mol-1,其线性对称分子结构使其不易被活化[16,20]。因此,在热力学上,CO₂的活化需要高能输入。受制于转化效率和选择性问题,目前的光催化CO₂还原研究仍处于实验室阶段。
现阶段光催化CO₂反应主要面临以下几方面挑战[3,16]:
① 催化剂有限的光吸收能力;
② 严重的光生载流子复合;
③ CO₂难于吸附活化;
④ 竞争反应(析氢反应)需被有效抑制;
⑤ 光催化剂的稳定性有待提升;
⑥ 待开发简便的催化剂合成工艺;
⑦ 缺乏大量反应机理研究,还原产物的选择性难于调控。
针对以上问题:
一方面可以通过设计合成高效催化剂提升光催化CO₂还原反应的转化效率和提高目标产物的选择性;
另一方面,泊菲莱科技期望与各位专家朋友们进行交流和深入合作,开发设计合理的反应器,通过优化反应工艺,积极推动光催化CO₂还原反应的相关研究。
